Процентная концентрация вещества есть доля, умноженная на 100.
ω = 100m(вещество) / m(раствор) = %
Молярность раствора есть отношение количества растворенного вещества, моль, к объему раствора, л.
См = n/V моль/л.
n — количества растворенного вещества, моль.
V — Объем в литрах.
Поскольку n = m/Mr,
См = m/(Mr*V)
Нормальность раствора есть отношение эквивалентного количества растворенного вещества, моль-экв., к объему раствора, л.
Сн = n э /V моль-экв./л.
n э — количество вещества эквивалента, n э = n/f.
f — фактор эквивалентности (см. раздел 12).
Поскольку n э = m/Mr*f,
Сн = m/(Mr*V*f)
Сн = См/f
Титр есть отношение массы растворенного вещества к объему раствора, г/мл.
T = m/V г/мл
Моляльность есть отношение количества растворенного вещества, моль, к массе растворителя, кг.
C m = n/m(растворитель) моль/кг.
Существуют специальные формулы для перевода одних концентраций в другие. Авторы намеренно отказались от пользования ими: идея приведенных решений в том, чтобы учащийся понял алгоритм решения таких задач.
4.Молярность и нормальность растворов. Подготовка к олипиадам по химии 8-9 класс.
Внимание! Для выражения одних концентраций через другие (перерасчета из одних концентраций в другие),
а также для проверки собственных расчетов можно воспользоваться on-line сервисом Пересчет концентраций растворов .
Поддержать проект
Группа: Супермодераторы
Сообщений: 6487
Статус: Offline
13.1.1. Определить процентную концентрацию КОН в растворе, если КОН массой 40 г растворен в воде массой 160 г.
Масса раствора составит m = m(KOH) + m(H 2 O) = 40 + 160 = 200 г.
ω = 100m(вещество) / m(раствор) = 100*40 / 200 = 20%.
Растворимость в данном случае обозначает массу вещества на 100 г. растворителя (вода)
Масса раствора составит 22 + 100 = 122 г.
ω = 100m(вещество) / m(раствор) = 100*22/122 = 18,03%.
13.1.3. Смешали 300 г 20%-го раствора, и 500 г 40%-го раствора NaCI. Чему равна процентная концентрация полученного раствор?
В 300 г 20%-го раствора содержится (применим обратную формулу) m(вещество) = ω*m(раствор)/100 = 20*300/100 = 60 г. соли.
В 500 г 40%-го раствора содержится m(вещество) = ω*m(раствор)/100 = 40*500/100 = 200 г. соли.
Суммарно соли будет m(вещество) = 60 + 200 = 260 г.
Масса полученного раствора составит, очевидно, m(раствор) = 300 + 500 = 800 г.
Итак,
ω = 100m(вещество) / m(раствор) = 100*260/800 = 32,5%.
13.1.4. Определить процентную концентрацию хлорида натрия в растворе, полученном при растворении соли массой 20 г в воде массой 300 г.
ω = 100m(вещество) / m(раствор) = 100*20/(20 + 300) = 6,25%.
13.1.5. Сколько граммов гидроксида натрия содержится в растворе массой 250 граммов с концентрацией 20%?
m(вещество) = ω*m(раствор)/100 = 20*250/100 = 50 г.
13.1.6 К 300 мл гидроксида калия с концентрацией 20% (плотность 1,2 г/мл) прибавили КОН массой 40 граммов. Определить процентную концентрацию КОН в новом растворе.
Как отмерить без весов любое удобрение для подкормки- полезная самоделка.
Плотность определяется по формуле: ρ = m/V
Отсюда, масса раствора связана с плотностью соотношением: m = ρV
Определим массу 300 мл гидроксида калия с концентрацией 20% с плотностью 1,2 г/мл.
m(раствор) = ρV = 1,2*300 = 360 г.
m(вещество) = ω*m(раствор)/100 = 20*360/100 = 72 г.
После прибавления КОН массой 40 граммов масса вещества станет равной 72 + 40 = 112 г.
Масса раствора станет равной 360 + 40 = 400 г.
ω = 100m(вещество) / m(раствор) = 100*112/400 = 28%.
13.1.7. К 200 мл раствора серной кислоты (пл. 1,066) с концентрацией 10% прилили 1 л воды (пл. 1). Определить процентную концентрацию серной кислоты в новом растворе.
13.1.8 При упаривании раствора хлорида натрия массой 500 граммов с концентрацией раствора 1% получили новый раствор массой 100 граммов. Какова процентная концентрация полученного раствора?
Поясним, что при упаривании из раствора испаряется вода, количество соли при этом остается неизменным. Поэтому ее концентрация возрастает.
Определим массу соли.
m(вещество) = ω*m(раствор)/100 = 1*500/100 = 5 г.
Масса упаренного раствора задана, 100 г.
ω = 100m(вещество) / m(раствор) = 100*5/100 = 5 %.
13.1.9. Сколько соли надо растворить в воде массой 2 кг, чтобы получить раствор с концентрацией 20%?
Пусть количество соли = х.
Тогда масса раствора составит 2000+х граммов.
Подставим в уравнение ω = 100m(вещество) / m(раствор) наши данные.
20 = 100х/(2000 + х)
х = 500 г.
13.1.10 Сколько воды надо прибавить к раствору массой 3 кг с концентрацией соли 20% для получения 15% раствора?
Пусть масса воды = х.
В растворе содержится 3000*20/100 = 600 г соли.
Масса раствора составит 3000+х граммов.
Подставим в уравнение ω = 100m(вещество) / m(раствор) наши данные.
15 = 100*600/(3000 + х)
х = 1000 г.
13.1.11. Какой объем воды (плотность 1) потребуется для растворения сахара массой 8 граммов, если в приготовленном растворе концентрация должна быть 1%?
Если 1% весит 8 г., то весь раствор весит (пропорция из арифметики для 5 класса):
1% — 8
100% — х
х = 800 г.
Воды в нем будет 800 — 8 = 792 г. При плотности, равной 1, это соответствует объему 792 мл.
13.1.12. Какое количество 10% р-ра соли надо добавить к 200 г. 40% р-ра, чтобы получить 25% раствор?
Чтобы лишний раз не возиться с множителем 100, выразим концентрацию не через процент, а в долях.
10% = 0,1, 40% = 0,4, 25% = 0,25.
Пусть масса искомого раствора = х, тогда масса соли в нем будет 0,1х.
Масса соли во втором растворе составит 200*0,4 = 80 г.
Наконец, масса полученного раствора будет равна х+200. Очевидно, что масса соли в нем будет 0,25(х + 200)
Так же очевидно, что масса соли в третьем растворе равна сумме масс солей в двух исходных.
Тогда,
0,1х + 80 = 0,25(х + 200)
х = 200 г.
Задачи подобного плана на поиск массы добавляемого раствора или определение соотношения смешиваемых растворов решаются по общему уравнению:
ω 1 m 1 + ω 2 m 2 = ω 3 (m 1 + m 2 )
13.1.13 Сколько граммов 80% и 20%-ной фосфорной кислоты следует взять для приготовления 3000 г 50%-ного раствора?
Пусть х — масса 80%-го раствора, тогда кислоты в нем содержится 0,8х.
Пусть у — масса 20%-го раствора, тогда кислоты в нем содержится 0,2у.
Приготовлено 3000 г раствора, в котором кислоты 3000*0,5 = 1500 г.
Можем составить систему уравнений:
0,8х + 0,2у = 1500
х + у = 3000
Решение системы приводит к ответам:
х = 1500
у = 1500
То есть, надо смешать по 1500 граммов.
Внимание! Для выражения одних концентраций через другие (перерасчета из одних концентраций в другие),
а также для проверки собственных расчетов можно воспользоваться on-line сервисом Пересчет концентраций растворов .
Поддержать проект
Источник: chemistlab.ru
Как приготовить 1, 3, 5, 8, 9, 10, 20 процентный солевой раствор? Для чего используется солевой раствор?

Точно так же, используя чайную ложку, можно приблизительно высчитать, сколько соли надо размешать в воде, чтобы получился раствор со всеми иными процентными соотношениями.

Важна правильная концентрация соли




Как приготовить 20-процентный солевой раствор?
- В некоторых случаях возникает нужда в 20-процентном солевом растворе. Как его приготовить?
- Если мы уже знаем, сколько воды и соли нужно взять для 10-процентного раствора, то в таком случае очень легко высчитать и 20% состав – просто соли для смеси нужно взять в два раза больше.
Словом «соль» в некоторых рецептах могут называться разные вещества. Чаще всего речь идет об обычной пищевой соли, реже – каменной или морской, а иногда солью называют натрия хлорид. Если вы внимательно прочтете нужный вам рецепт, то, скорее всего, вы отыщете, каким именно веществом вам нужно воспользоваться в вашем случае. А есть еще и народные рецепты, в которых как об «английской соли» говорят о сульфате магния.
Какую соль и воду использовать для солевого раствора в лечебных целях?
- Если вам понадобится заняться полосканием больного горла или, например, унять зубную боль, то тогда лучше всего использовать натрия хлорид. Используйте для этого только качественные ингредиенты – в таком случае солевой раствор вам принесет облегчение, а не нанесет вред вашему здоровью.
- Так какую же соль следует выбрать именно для лекарственных целей? В каменной соли имеются довольно многочисленные лишние примеси, и потому в этом случае лучше пользоваться обычной мелкой; чтобы полоскать горло, прекрасно подойдет и йодированная соль.
- Какой должна быть вода для получения качественного солевого раствора? Дома можно пользоваться отфильтрованной или, в крайнем случае, кипяченой водой. Некоторые народные рецепты предлагают пользоваться дождевой водой или растопленным снегом. Возможно, раньше это и было возможным, но в наше время экология настолько засорена, что даже саму мысль об их использовании нужно выбросить из головы.
- Если вы не пользуетесь фильтром, очистите воду «дедовским» способом, заморозив ее в морозильной камере. При замерзании в первую очередь льдом становится наиболее чистая вода, а все, что было в ней грязное и вредное, опустится вниз. Не ждите, пока вода в емкости замерзнет полностью — осторожно снимайте лед сверху, а затем при потребности растапливайте ее. Из очищенной таким образом воды получится абсолютно безвредный для здоровья солевой раствор.

Соль для раствора
Лечение бородавок и папиллом солью
Бородавки на теле, особенно на лице выглядят некрасиво, поэтому каждый человек хотел бы от них избавиться.
Противовирусное действие белых кристаллов высоко оценили народные целители. С помощью солевых примочек хорошо лечатся всевозможные кожные заболевания: экзема, псориаз, бородавки, папилломы, пигментные пятна. Рак кожи тоже не может противостоять хлористому натрию, особенно в начальной стадии.
Как воздействовать на бородавки и другие наросты:
- Сначала пораженный участок необходимо обработать антисептиком;
- Смочить водой;
- На влажный диск насыпать мелкой соли, затем натереть новообразование.
Такую процедуру придется делать целый день каждые 2–3 часа. Отрывать новообразование нельзя, оно должно отвалиться само. Потом его можно сдать в лабораторию, чтобы убедиться в его доброкачественности.
Очень простой рецепт избавления от бородавок на руках: в мешочек насыпать соль, руки ввести в мешок и начинать «мыть» руки солью. Через несколько сеансов руки очистятся.
Как правильно приготовить солевой раствор?
Для получения эффективного натурального солевого раствора можно воспользоваться несколькими методами:
- довести воду с солью до кипения (но не кипятить) в микроволновке;
- на плите;
- залить насыпанную в чашку соль нужным количеством горячей воды из чайника.
Как быть с остатками смеси из соли и воды? Их нужно перелить в какую-нибудь (лучше всего стеклянную) стерильную емкость с плотно закрывающейся крышкой. Жидкость сохраняет свои полезные свойства в течение суток, потом, если вы не успели за это время ее использовать, просто вылейте – воду с солью экономить не стоит.
Способ улучшения пищеварения
Академик Болотов советовал выработать у себя такую привычку: после еды, причём после любой, класть на язык несколько кристаллов соли и медленно их рассасывать, потом проглатывать. Такое действие надо проводить даже если едите сладости или фрукты.
Соль поможет наладить правильное пищеварение и поддержать в организме нужный кислотно-щелочной баланс. Необходимо брать нерафинированную соль («Экстра» не подойдёт).
Белые кристаллы способствуют выделению желудочного сока, ферменты которого убивают болезнетворные, даже раковые клетки. Не стоит опасаться за здоровые клетки, они остаются невредимыми.
Соль это не панацея от всех заболеваний, но наряду с лекарственными препаратами, которые прописывает доктор, целители советуют применять и этот продукт.
Зачем нужен солевой раствор?
Солевой раствор для суставов
- Солевой повязкой пользуются при возникновении растяжения связок и для снятия сопутствующей ей опухоли. Она поможет не допустить развития воспалительных процессов и снять отеки, возникшие в поврежденных тканях.
- Чаще всего для солевых повязок используют 10-процентный (реже – 8-%) раствор, т.е. берут один литр воды и растворяют в ней 100 г соли.
- В этом случае используется только каменная соль. Для таких повязок лучше всего использовать какое-нибудь старое мягкое хлопчатобумажное полотенце, медицинскую марлю, сложенную в несколько слоев или вату для тампонов — гигроскопичную, а лучше – вискозную. Не стоит ожидать быстрого эффекта: иногда для того чтобы полностью победить болезнь, приходится менять повязки неделю, а то и целых десять дней.
Солевой раствор при рините, от головной боли
- Если вас измучил насморк или головная боль, то в таком случае воспользуйтесь круговой (чтобы захватила лобную и затылочную части головы) повязкой.
- Приложите ее, когда вы уже будете отправляться спать, и через несколько часов вы избавитесь и от насморка, и от головной боли. При этом вам будет нужно сделать 8-процентный раствор соли (80 г соли на литр воды).

При головной боли
Солевой раствор при заболеваниях печени
- Боли от воспалительного процесса в желчном пузыре, холецистите, циррозе можно значительно уменьшить или даже снять вовсе при помощи солевой повязки, приложенной к области печени.
- Для этого потребуется 10-процентный раствор соли – в нем нужно смочить х/б ткань, сложенную в 4 раза и приложить ее слева – от груди до середины живота по длине, а по ширине окутать участок, расположенный ниже грудных желез вплоть до позвоночника.
- Прибинтуйте повязки посредством широкого бинта достаточно туго — чтобы они не сдвигались, но и можно было свободно дышать и двигаться (живот нужно увязать более туго, чем в других местах). Кладется такая повязка на 10 часов, потом ее потребуется убрать, а на подложечной области разместить грелку с горячей водой на 0,5 часа.
- Этого достаточно для того чтобы желчные протоки расширились и сгустившаяся желчная масса могла свободно опуститься в кишечник.
Солевой раствор при мастопатию и онкозаболевания молочных желез
- При таких болезнях также используется 10-% раствор соли. Четырехслойную, но не слишком сдавливающую повязку прикладывают к обеим молочным железам на ночь (достаточно ее продержать 8-10 час.).
- Лечиться нужно при мастопатии в течение двух недель; при онкозаболевании – трех. Некоторые женщины могут испытывать при наложении повязки некоторый сбой сердечного ритма – тогда нужно применять солевой раствор через день.
Солевой раствор при тонзиллите
- При таких заболеваниях промывается нос солевым раствором. При этом нужно взять 0,5 ч. л. соли и расколотить ее в 200 мл доведенной до кипения воды.
- Для действенного лечения нужно научиться одной ноздрей втягивать смесь, а потом сплевывать ее ртом. Настоящие «виртуозы», которые уже поднаторели в этом деле, научились даже переливать ее из одного ноздревого отверстия в другое.

Промывание носа солевым раствором
Солевой раствор при других заболеваниях
- Солевая повязка помогает смягчить течение болезни при ангине, бронхите, остеохондрозе шейного отдела, снимает сильную боль в животе и от полученных ушибов.
- В этих случаях вам понадобится взять 2 ч. л. соли «с горкой» и развести их в 200 г воды (для маленьких детей потребуется 250 г жидкости).
- Потребуется кусок мягкой натуральной ткани или марли (ее нужно сложить в 8 слоев) смачивать в этом растворе и прикладывать к больной части тела. Держать такую повязку допускается до 12-ти часов; фиксировать – при помощи бинта либо х/б платка.
Если, несмотря на применение солевых повязок или растворов заболевание продолжает развиваться, то в таком случае вам потребуется срочно обратиться к доктору.
Также советуем прочесть такие статьи о соли:
- Как промывать нос морской солью ребенку и взрослому
- Пересолила кашу: что делать
- Заговор на соль
- Ванна с пищевой и морской солью для похудения
- Пищевая соль: польза и вред, суточная норма соли для человека
Проверенные народные рецепты
Многие люди на себе проверили, как быстро лечатся ушибы, если прикладывать к ним гипертонический концентрат. Достаточно 3 дней, чтоб след от ушиба начал рассасываться. Подкожная гематома тоже может исчезнуть, если прикладывать на неё рыхлую соленую марлю.
Ушибы, гематомы лучше лечить 10%-ной жидкостью, которую накладывают на 5-8 часов в течение трех дней. Солевые повязки обладают настолько сильным действием, что даже при очень сильных ушибах происходит излечение.
Известен случай, когда абсцесс плеча излечивался за 9 дней. За этот период снижалась температура, проходила багровость, а потом исчезло и уплотнение.
Если вас кто-то укусил: насекомые или животные, то их укусы тоже можно полечить солью. От некоторых насекомых может остаться такой отёк, что может перейти в нарыв. Почему от насекомых остается отёк? Их слюна настолько ядовита, что несёт угрозу очень чувствительным людям, особенно детям.
Как только у ребенка появится опухоль после укуса мошки, не ждите печальных последствий, сразу наложите 8% повязочку. От укуса может появиться сильный зуд. Потрите зудящее место солью. Поможет также сода.
Еще опаснее укусы домашних животных. Если есть возможность, то сразу обратитесь в поликлинику. Но бывают случаи, когда до больницы далеко, а опухоль от укуса растекается все сильнее.
Укус от животного, которое живёт дома и не страдает бешенством, может считаться безопасным. Необходимо сделать тёплую солевую ванну: на полную ванну насыпать 2–3 кг соли. Принимать ванну от 30 до 50 минут. Потом ополоснуться тёплой водичкой, попить зольной жидкости с мёдом.
Если нет возможности принять полную ванну, необходимо сделать горячий раствор в тазу: 0,4 кг соли на тазик. На 20 минут поместите в жидкость укушенную ногу или руку, потом надо выпить зольной воды.
Приготовление зольной воды: в полотняный мешочек насыпать золы, промыть холодной водой. На промытой золе настоять воду, процедить, до приятного вкуса добавить мёд.
Источник: ufa-medtehnika.ru
Как вычислить процентную концентрацию раствора
Задания на вычисление процентной концентрации растворов приходится выполнять не только при изучении раздела химии. Умение проводить соответствующие расчеты могут сослужить хорошую службу в повседневной жизни, например, при перерасчете концентрации раствора уксусной кислоты в период консервирования овощей.

Статьи по теме:
- Как вычислить процентную концентрацию раствора
- Как найти концентрацию
- Как приготовить раствор заданной концентрации
Вам понадобится
- — калькулятор.
Инструкция
Любой раствор состоит из растворенного вещества и растворителя. В большинстве случаев растворителем выступает вода. Чтобы вычислить процентную концентрацию (или массовую долю растворенного вещества) необходимо воспользоваться формулой:W = m (растворенного вещества) / m (раствора) х 100 %W – массовая доля растворенного вещества (или процентная концентрация), %Из этой же формулы можно вывести и массу растворенного вещества, если известны масса раствора и процентная концентрация раствора.
Пример № 1. Вычислите массовую долю (в процентах) поваренной соли (NaCl), если масса (NaCl) 5 г, а масса раствора (NaCl) 100 г.В данной задаче остается только подставить в формулу предложенные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (NaCl) = m (NaCl) / m (раствора NaCl) х 100 %W (NaCl) = 5 г / 100 г х 100 % = 5 %Ответ: W (NaCl) = 5 %
Пример № 2. Вычислите массовую долю (в процентах) бромида калия (KBr), если масса соли (KBr) 10 г, а масса воды 190 г.Прежде чем работать с формулой на вычисление процентной концентрации, рассчитайте массу раствора, который состоит из воды и растворенного вещества:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра KBr) = 10 г + 190 г = 200 гПодставьте в основную формулу найденные и указанные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (KBr) = m (KBr) / m (раствора KBr) х 100 %W (KBr) = 10 г / 200 г х 100 % = 5 %Ответ: W (KBr) = 5 %
Пример № 3. Вычислите процентную концентрацию уксусной кислоты (СН3СООН), если масса кислоты (СН3СООН) 30 г, а масса воды 170 г.Рассчитайте массу раствора, который состоит из воды и уксусной кислоты:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра СН3СООН) = 30 г + 170 г = 200 гПодставьте в формулу необходимые параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (СН3СООН) = m (СН3СООН) / m (раствора СН3СООН) х 100 %W (СН3СООН) = 30 г / 200 г х 100 % = 15 %Ответ: W (СН3СООН) = 15 %
Совет полезен?
Статьи по теме:
Добавить комментарий к статье
Похожие советы
- Как найти концентрацию кислоты
- Как рассчитать концентрацию вещества
- Как найти процентную концентрацию
- Как вычислить концентрацию
- Как записать рациональное выражение концентрации раствора
- Как вычислить концентрацию веществ
- Как вычислить исходные концентрации
- Как определить концентрацию кислоты
- Как решать задачи на концентрацию
- Как вычислить массовую долю вещества
- Как вычислить массовую долю в процентах
- Как определить массовую долю раствора
- Как найти массовую долю вещества
- Как найти массовую долю
- Как определить молярную концентрацию
- Как вычислить молярную концентрацию
- Как определить массовую долю вещества
- Как вычислить моляльную концентрацию
- Как вычислить массовую долю, если известна плотность
- Как рассчитать концентрацию раствора
- Как определять исходную концентрацию вещества
- Как найти массу растворенного вещества
- Как рассчитать молярную концентрацию
- Как вычислить массовую долю
Источник: www.kakprosto.ru
Приготовление раствора определенной концентрации растворенного вещества
Задача 396.
Сколько граммов 30%-ного (по массе) раствора нужно добавить к 300 г воды, чтобы получить 10%-ный раствор соли?
Решение:
Обозначим массу 30% раствора NaCl, который необходимо добавить к 300 г воды через x, а массу NaCl в данном растворе можно обозначить как 03x. Для расчета используем формулу:
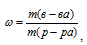

где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда массу раствора обозначим как m(р-ра) = 300 + х, = 10% или 0,1, а массу растворённого
NaCl — m(в-ва) = 300 . 0,1, = 0,3г.
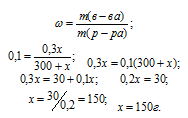
Ответ: 150 г.
Задача 397.
В какой массе воды надо растворить 67,2 л НСl (объем измерен при нормальных условиях), чтобы получить 9%-ный (по массе) раствор НСl?
Решение:
1 моль любого газа занимает объём 22,4 л. Тогда массу НСl рассчитаем из пропорции:
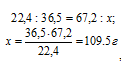
где
36,5 – молекулярная масса НСl.
Расчет массы воды производим, используя формулу:
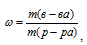

где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Обозначим массу воды через x. Тогда m(р-ра) = x + m(в-ва)
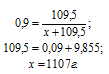
Ответ: 1107 г.
Задача 398.
Какую массу 20%-ного (по массе) раствора КОН надо добавить к 1 кг 50%-ного (по массе) раствора, чтобы получить 25%-ный раствор?
Решение:
Для решения задачи используем формулу:
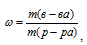

где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Находим массу КОН в 1000 г 50%-ного (по массе) раствора:
m(KOH) = . m(р-ра) = 0,5 . 1 = 0,5 кг.
Обозначим массу добавленного раствора 20% КОН через x, а массу КОН в этом растворе как 0,2x.
Исходя из этого, рассчитаем массу добавленного раствора:
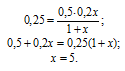
Таким образом, масса 20% раствора КОН, которую нужно добавить, составляет 5кг.
Ответ: 5 кг.
Задача 399.
Определить массовую долю вещества в растворе, полученном смещением 300 г 25%-ного и 400 г 40%-ного (по массе) растворов этого вещества.
Решение:
Для решения задачи используем формулу:
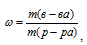

где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Находим массу раствора после смешения:
m(р-ра) = 300 + 400 = 700 г.
Массы растворённого вещества в каждом растворе можно найти из выражения:
Теперь находим массу растворённого вещества после смешения:
m(в-ва) = m1 + m2 = (0,25 . 300) + (0,4 . 400) = 235 г. .
Находим массовую долю вещества в растворе после смешения двух растворов:
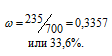
Ответ: 33,6%.
Задача 400.
Из 400 г 20%-ного (по массе) раствора при охлаждении выделилось 50г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
Решение:
В 400г 20%-ного раствора содержится 80 г растворённого вещества (0,2 . 400 = 80) и 320 г растворителя
(400 – 80 = 320). При охлаждении количество растворителя не изменилось. Содержание растворённого вещества в 320г растворителя составляет 30 г (80 – 50 = 30). Масса оставшегося раствора составляет 350 г (320 + 30 = 350). Для расчетов используем формулу:

,

где
— массовая доля растворённого вещества; m (в-ва) — масса растворённого вещества; m (р-ра) — масса раствора.
Находим массовую долю вещества в растворе после охлаждения:
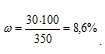
Ответ: 8,6%.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- рН раствора, полученного смещением | Задачи 549 — 551
Источник: buzani.ru
Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:

т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет

Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOH2O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10H2O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10H2O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:

Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:

Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10H2O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (NH4)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:

Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.

Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.

Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:

где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:

Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:

т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:

а объем воды v для разбавления раствора вычисляют по формуле:

Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:

Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков.
Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу.
Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.

Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:

Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:

Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:

Пример. Нужно приготовить стандартные растворы CuSO4 • 5H2O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять

Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5H2O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:

На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
Источник: himikatus.ru