Совокупность частот (или длин волн), которые содержатся в излучении какого-либо вещества, называютспектром испускания. Они бывают трех видов.
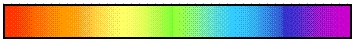
Сплошной — это спектр, содержащий все длины волн определенного диапазона от красного с λ ≈ 7,6 . 10 -7 м до фиолетового с λ ≈ 4 . 10 -7 м. Сплошной спектр излучают нагретые твердые и жидкие вещества, газы, нагретые под большим давлением.
Линейчатый — это спектр, испускаемый газами, парами малой плотности в атомарном состоянии. Состоит из отдельных линий разного цвета (длины волны, частоты), имеющих разные расположения. Каждый атом излучает набор электромагнитных волн определенных частот. Поэтому каждый химический элемент имеет свой спектр
Полосатый—это спектр, который испускается газом в молекулярном состоянии.
Линейчатые и полосатые спектры можно получить путем нагрева вещества или пропускания электрического тока.
Спектры поглощения
Спектры поглощения получают, пропуская свет от источника. дающего сплошной спектр, через вещество, атомы которого находятся в невозбужденном, состоянии.
Физика 11 класс (Урок№19 — Излучение и спектры.)
Спектр поглощения — это совокупность частот, поглощаемых данным веществом.
![]()
Согласно закону Кирхгофа вещество поглощает те линии спектра, которые и испускает, являясь источником света.
Этот метод очень чувствителен. Отдельные линии в спектрах различных элементов могут совпадать, но в целом спектр каждого элемента является его индивидуальной характеристикой. Спектральный анализ сыграл большую роль в науке. С его помощью был изучен состав Солнца и звезд.
В спектре Солнца (1814) были открыты фраунгоферовы темные линии.
Солнце — раскаленный газовый шар (Т ≈ 6000 °С), испускающий сплошной спектр. Солнечные лучи проходят через атмосферу Солнца, где Т ≈ 2000— 3000 °С.
Корона поглощает из сплошного спектра определенные частоты, а мы на Земле принимаем солнечный спектр поглощения. По нему можно определить, какие элементы присутствуют в короне Солнца.
Он помог обнаружить все земные элементы, а также неизвестный элемент, который назвали гелий. Через 26 лет (1894) открыли гелий на Земле. Благодаря спектральному анализу открыто 25 элементов.
Благодаря сравнительной простоте и универсальности спектральный анализ является основным методом контроля состава вещества в металлургии и машиностроении. С помощью спектрального анализа определяют химический состав руд и минералов,
Спектральный анализ можно производить как по спектрам испускания, так и по спектрам поглощения.
Состав сложных смесей анализируется по молекулярному спектру.
ЛАЗЕРЫ
В 1917 г. А. Эйнштейн предсказал возможность перехода атома с высшего энергетического состояния в низшеепод влиянием внешнего воздействия — вынужденного излучения. В 1940 г. В. А. Фабрикант указал на возможность использования вынужденного излучения для усиления электромагнитных волн. Отечественные ученые Н. Г. Басов и А. М. Прохоров и независимо американец Ч. Таунс изобрели квантовый оптический генератор (1954) и получили Нобелевскую премию.
52 Типы оптических спектров Поглощение и испускание света атомами Происхожден online video cutter
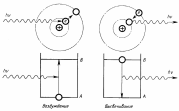
Фотон, имеющий энергию hv, возбуждает атом и переводит электрон в состояние с более высокой энергией. Электрон произвольно возвращается в первоначальное состояние, испуская фотон энергией hv.
Вынужденное излучение
Падающий фотон с энергией hv взаимодействует с атомом, находящимся в возбужденном состоянии, и стимулирует его высвечивание. Возникают два фотона с энергией hv каждый, которые движутся в одном направлении и одной фазе.
Населенность уровней
В условиях теплового равновесия большая часть атомов обладает минимумом энергии, населенность верхних уровней меньше населенности нижних. Под влиянием энергетических воздействий (повышение температуры, освещение) возбуждение атомов возрастает и населенность верхних уровней увеличивается, но получить распределение частиц но уровням, при котором населенность верхних уровней больше, чем нижних, таким способом невозможно, так как увеличение населенности верхних уровней способствует увеличению спонтанных переходов на нижний уровень. Атомы могут находиться в возбужденном состоянии 10 -8 с.
![]()
Чтобы получить когерентное излучение в результате вынужденного испускания, необходимы два условия:
1. Населенность верхних уровней должна быть больше, чем нижних.
2. Один из верхних уровней с состоянием Е2 должен быть метастабильным, т. е, электроны в нем должны находиться не
10 -8 с, а порядка 10 -5 —10 -3 с. Уровень с состоянием Е2 метастабильный. Если вещество (например, кристалл рубина) длительное время освещать, то произойдет очень плотное заселение метастабильных уровней. При наличии уровня с состоянием Е2 возможны спонтанные переходы из состояния Е3 не только в основное состояние Е1, но и на метастабильный уровень с состоянием Е2
Оба перехода сопровождаются выделением энергии. Большое различие во временах жизни в состояниях Е2 и Е3приводит к тому, что под действием возбуждающих фотонов с энергией атомы переходят в состояние Е3, а затем самопроизвольно — в состояние Е2. Без излучения света (энергия поглощается кристаллом) и происходит накопление атомов на метастабильном уровне с состоянием Е2. Для создания в лазере инверсной населенности используют Al2O3, смесь гелия (15%), неона (85%) и другие вещества. Переход из состояния Е2 в состояние Е3 под действием внешней электромагнитной волны сопровождается излучением, что и используется в лазерах.
Свойства лазерного излучения
- Малый угол расхождения пучка света,
- Исключительная монохроматичность.
- Самые мощные источники света—10 14 Вт/с, Солнце— 7 . 10 3 Вт/с.
- КПД около 1%.
В настоящее время лазеры применяются:
- Медицина (в физиотерапии, лазерные скальпели в микрохирургии, для лечения глаз)
- Лазерная резка и сварка металлов
- Оптические системы наводки в военных и локационных целях
- При изучении оптических явлений
- Лазерный термоядерный синтез и т.д.
Источник: www.eduspb.com
Инфофиз. Репетитор по физике и информатике
Урок 52. Виды спектров. Различные виды электромагнитных излучений, их свойства.
Совокупность монохроматических компонент в излучении называется спектром.
Спектры излучения
Спектральный состав излучения веществ весьма разнообразен. Но, несмотря на это, все спектры, как показывает опыт, можно разделить на три типа.
Непрерывные спектры
Непрерывный спектр представлет собой сплошную разноцветную полосу.
Белый свет имеет непрерывный спектр. Солнечный спектр или спектр дугового фонаря является непрерывным. Это означает, что в спектре представлены волны всех длин. В спектре нет разрывов, и на экране спектрографа можно видеть сплошную разноцветную полосу.
Непрерывные (или сплошные) спектры, как показывает опыт, дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры. Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.
Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом.
Излучение источников, в которых свет испускается атомами вещества, имеет дискретный спектр. Они делятся на:
1. линейчатый

2. полосатый
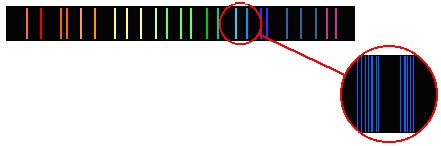
Линейчатые спектры
Линейчатый спектр состоит изотдельных цветных линий различной яркости, разделенных широкими темными полосами.
Внесем в бледное пламя газовой горелки кусочек асбеста, смоченного раствором обыкновенной поваренной соли. При наблюдении пламени в спектроскоп на фоне едва различимого непрерывного спектра пламени вспыхнет яркая желтая линия. Эту желтую линию дают пары натрия, которые образуются при расщеплении молекул поваренной соли в пламени.
На рисунке приведены также спектры водорода и гелия. Такие спектры называются линейчатыми. Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах).

Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном) состоянии. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Изолированные атомы излучают строго определенные длины волн.
Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом.
При увеличении плотности атомарного газа отдельные спектральные линии расширяются, и, наконец, при очень большом сжатии газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Полосатые спектры
Полосатый спектр состоит из отдельных полос, разделенных темными промежутками.
С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда.
Спектры поглощения
Все вещества, атомы которых находятся в возбужденном состоянии, излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Так, красное стекло пропускает волны, соответствующие красному свету, и поглощает все остальные.
Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появляются темные линии. Это будет спектр поглощения.

Спектр поглощения представляет собой темные линии на фоне непрерывного спектра источника.
Газ поглощает наиболее интенсивно свет как раз тех длин волн, которые он испускает в сильно нагретом состоянии. Темные линии на фоне непрерывного спектра — это линии поглощения, образующие в совокупности спектр поглощения.
Существуют непрерывные, линейчатые и полосатые спектры поглощения.
Различные виды электромагнитных излучений, их свойства и практические применения.
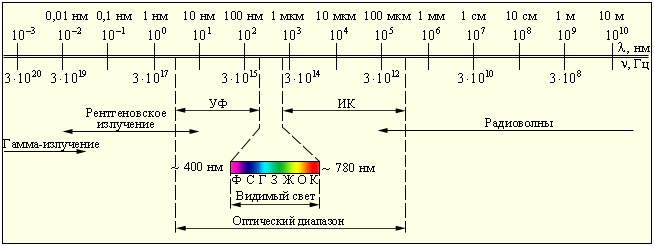
Шкала электромагнитных волн. Границы между различными диапазонами условны
Низкочастотные колебения.
Постоянный ток – частота ν = 0 – 10 Гц.
Атмосферные помехи и переменный ток – частота ν = 10 – 10 4 Гц
Частота ν =10 4 – 10 11 Гц
Длина волны λ = 10 -3 – 10 3 м
Получают с помощью колебательных контуров.
Радиоволны различных частот и с различными длинами волн по разному поглощаются и отражаются средами, проявляют свойства дифракции и интерференции.
Радиосвязь, телевидение, радиолокация.
Инфракрасное излучение.
Частота ν =3·10 11 – 4·10 14 Гц
Длина волны λ = 8·10 -7 – 2·10 -3 м
Излучаются атомами и молекулами вещества.
Инфракрасное излучение дают все тела при любой температуре. Человек излучает электромагнитные волны λ ≈ 9·10 -6 м.
- Проходит через некоторые непрозрачные тела, а также сквозь снег, дождь, дымку.
- Производит химическое действие на фотопластинки.
- Поглощаясь веществом, нагревает его.
- Вызывает внутренний фотоэффект у германия.
- Невидимо.
- Способно к явлениям интерференции и дифракции.
- Регистрируют тепловыми методами, фотоэлектрическими и фотографическими.
Получают изображения предметов в темноте, приборах ночного видения, в тумане. Используют в криминалистике, в физиотерапии,. в промышленности для сушки окрашенных изделий, стен зданий, древесины, фруктов.
Видимое излучение.
Часть электромагнитного излучения, воспринимаемая глазом (от красного до фиолетового).
Частота ν =4·10 14 – 8·10 14 Гц
Длина волны λ = 8·10 -7 – 4·10 -7 м
Отражается, преломляется, воздействует на глаз, способно к явлениям дисперсии, интерференции, дифракции.
Ультрафиолетовое излучение.
Частота ν =8·10 14 – 3·10 15 Гц
Длина волны λ =·10 -8 – 4·10 -7 м (но меньше, чем у фиолетового света)
Излучается всеми твердыми телами, у которых t > 1000°С, а также светящимися парами ртути.
- Высокая химическая активность (разложение хлорида серебра, свечение кристаллов сульфида цинка).
- Невидимо.
- Большая проникающая способность.
- Убивает микроорганизмы.
- В небольших дозах благотворно влияет на организм человека (загар), но в больших дозах оказывает отрицательное биологическое воздействие: изменение в развитии клеток и обмене веществ, действие на глаза.
В медицине, в косметологии (солярий, загар), в промышленности.
Рентгеновские лучи.
Частота ν =3·10 15 – 3·10 19 Гц
Длина волны λ =·10 -11 – 4·10 -8 м
Излучаются при резком торможении электронов, движущихся с большим ускорением.
Получают при помощи рентгеновской трубки: электроны в вакуумной трубке ускоряются электрическим полем при высоком напряжении, достигая анода, при соударении резко тормозятся. При торможении электроны движутся с ускорением и излучают электромагнитные волны с малой длиной (от 100 до 0,01 нм).
- Интерференция, дифракция рентгеновских лучей на кристаллической решетке.
- Большая проникающая способность.
- Облучение в больших дозах вызывает лучевую болезнь.
В медицине (диагностика заболеваний внутренних органов), в промышленности (контроль внутренней структуры различных изделий, сварных швов).
Гамма – излучение (γ – излучение).
Частота ν =3·10 20 Гц и выше
Длина волны λ =3,3·10 -11 м
- Имеет огромную проникающую способность.
- Оказывает сильное биологическое воздействие.
В медицине, в производстве (γ – дефектоскопия).
Подробности Просмотров: 89852
Вопросы к экзамену
Для студентов всех групп технического профиля Нвороссийского колледжа строительства и экономики (НКСЭ)
Законы и формулы
- Механика
- Кинематика
- Динамика
- Законы сохранения
- Статика, гидростатика и гидродинамика
Для улучшения работы сайта и его взаимодействия с пользователями мы используем файлы cookie, которые сохраняются на Вашем компьютере. Нажимая СОГЛАСЕН, Вы подтверждаете то, что Вы проинформированы об использовании cookies на нашем сайте и разрешаете использование cookie-файлов. Отключить cookies Вы можете в настройках своего браузера.
- Тестирование
- Обратная связь
- Обо мне
- Карта сайта
- Правообладателям
- Политика конфиденциальности
Сейчас 136 гостей и ни одного зарегистрированного пользователя на сайте
Если Вы являетесь автором материалов или обладателем авторских прав, и Вы возражаете против его использования на моем интернет-ресурсе — пожалуйста, свяжитесь со мной. Информация будет удалена в максимально короткие сроки.
Спасибо тем авторам и правообладателям, которые согласны на размещение своих материалов на моем сайте! Вы вносите неоценимый вклад в обучение, воспитание и развитие подрастающего поколения.
Источник: infofiz.ru
Линейчатые спектры

Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то на экране получится хорошо известный нам спектр. Спектр, который вы видите ниже, называется непрерывным спектром. Он представляет собой сплошную полосу, состоящую из разных цветов, плавно переходящих друг в друга. Непрерывный (сплошной) спектр— разновидность спектра, в которой присутствуют все длины волн видимого диапазона (от красной границы до фиолетовой). Излучения, обладающие непрерывным спектром:
- свет, излучаемый Солнцем;
- искусственный свет от лампы дневного освещения;
- любые твердые и жидкие тела, плотные газы, нагретые до высокой температуры.
Пример №1. Будет ли излучать свет в непрерывном спектре спираль работающей электроплиты?
В данном случае да, поскольку спирать — твердое тело, нагретое до высокой температуры.
Линейчатый спектр и его виды
Картина резко меняется, когда мы наблюдаем свечение, излучаемое разреженными газами. Спектр перестает быть непрерывным: в нём появляются разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым.
Линейчатый спектр — спектр, который состоит из отдельных достаточно тонких линий.
Линейчатый спектр бывает двух видов:
- спектр испускания;
- спектр поглощения.
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до очень высокой температуры), мы сможем наблюдать такую картину, как на картинке ниже.

Спектр испускания — линейчатый спектр, который состоит из тонких изолированных разноцветных линий, соответствующих тем длинам волн света, который излучается атомами.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Но наибольшую важность имеет то, что для любого химического элемента спектр испускания является уникальным. Поэтому по нему можно устанавливать, какой химический элемент находится перед нами. Он является своего рода идентификатором.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем сделать следующий вывод:
Свет излучают атомы сами по себе. Следовательно, каждый атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента этот набор свой.
Спектр поглощения
Атомы излучают свет в процессе перехода из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. При поглощении света атом совершает обратный процесс — он переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но теперь в охлажденном состоянии (при довольно низкой температуре). Свечения газа в этом случае мы не увидим. В не нагретом состоянии газ не излучает свечение, так как атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь охлажденный газ пропустить свет с непрерывным спектром, мы увидим следующую картину (см. рисунок ниже).

Спектр поглощения — темные линии на фоне непрерывного спектра, соответствующие тем длинам волн света, которые поглощаются атомами и излучаются впоследствии при сильном нагревании.
Объясним, откуда берутся темные линии. Под действием падающего света газовые атомы переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов нужны не любые длины волн, а лишь некоторые, строго определённые для данного вида газа. Именно эти длины волн газ поглощает из падающего на него света.
Внимание! Газ поглощает те длины волн, которые излучает сам. Поэтому, цветные линии на спектре испускания соответствуют темным линиям на спектре поглощения. Если их сложить, можно получить непрерывный спектр.
На рисунке ниже сопоставлены спектры испускания и поглощения разреженных паров натрия.
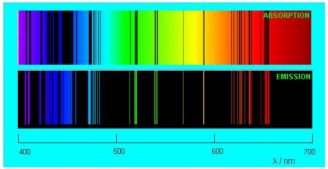
Глядя на спектры испускания и поглощения, ученые XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. Ведь что-то внутри атома должно обеспечивать процессы излучения и поглощения света.
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов. Поэтому атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Спектральный анализ
Использование линейчатых спектров в качестве идентификаторов химических элементов лежит в основе спектрального анализа.
Спектральный анализ — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа заключается в следующем. Спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов. Затем делается вывод о присутствии или отсутствии различных химических элементов в исследуемом образце. При определённых условиях посредством спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы. Первыми из таких элементов были цезий и рубидий. Названия эти элементы получили по цвету линий своего спектра. Так, в спектре цезия больше всего выражены две линии небесно-синего цвета, который на латинском языке звучит как caesius. Рубидий же даёт две отчетливые линии рубинового цвета.
В 1868 году в спектре солнечного света были обнаружены линии, не соответствующие ни одному из известных химических элементов. Этот элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был найден в атмосфере нашей планеты. Спектральный анализ излучения Солнца и других звезд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же набора элементов.
Пример №2. Какую картинку можно получить, если провести спектральный анализ вещества, состоящего из двух химических элементов?
Спектры испускания и спектры поглощения будут накладываться друг на друга. В итоге можно будет получить спектр испускания, в котором будут присутствовать все длины волн, соответствующие тем, что испускаются первым и вторым химическим элементом. В спектре поглощения эти же длины волн будут отсутствовать.
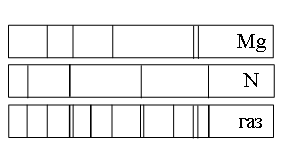
На рисунке приведены спектр поглощения неизвестного газа и спектры поглощения атомарных паров известных элементов. По виду спектров можно утверждать, что неизвестный газ содержит атомы
а) азота (N), магния (Mg) и другого неизвестного вещества
б) только азота (N)
в) только магния (Mg)
г) только магния (Mg) и азота (N)
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного газа.
- Сравнить спектр поглощения неизвестного газа и магния. Сделать вывод о том, присутствует ли магний в газе.
- Сравнить спектр поглощения неизвестного газа и азота. Сделать вывод о том, присутствует ли азот в газе.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит этот элемент.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения магния. Следовательно, этот газ содержит магний.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения азота. Следовательно, этот газ также содержит азот.
Но кроме линий, соответствующих азоту и магнию, на спектре поглощения газа наблюдаются другие линии. Следовательно, газ содержит как минимум еще один элемент.
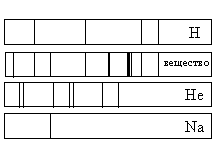
На рисунке приведены спектр поглощения разреженных атомарных паров неизвестного вещества (в середине) и спектры поглощения паров известных элементов (вверху и внизу). По анализу спектров можно утверждать, что неизвестное вещество содержит
а) только натрий (Na) и водород (Н)
б) только водород (Н) и гелий (Не)
в) водород (Н), гелий (Не) и натрий (Na)
г) натрий (Na), водород (H) и другие элементы, но не гелий (He)
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного газа.
- Сравнить спектр поглощения неизвестного вещества и водорода. Сделать вывод о том, присутствует ли водород в веществе.
- Сравнить спектр поглощения неизвестного вещества и гелия. Сделать вывод о том, присутствует ли гелий в веществе.
- Сравнить спектр поглощения неизвестного вещества и натрия. Сделать вывод о том, присутствует ли натрий в веществе.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит данный элемент.
Видно, что спектр поглощения неизвестного вещества включает в себя все линии, которые есть в спектре поглощения водорода и натрия. Но линий, соответствующих спектру поглощения гелия, в нем нет. Следовательно, это вещество содержит водород, натрий, но не содержит гелий.
Кроме линий, соответствующих водороду и натрию, на спектре поглощения вещества наблюдаются другие линии. Следовательно, оно содержит как минимум еще один элемент.
На рисунках А, Б и В приведены спектры излучения паров кальция Ca, стронция Sr и неизвестного образца.
Можно утверждать, что в неизвестном образце
а) не содержится стронция
б) не содержится кальция
в) содержатся кальций и ещё какие-то элементы
г) содержится только кальций
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного образца.
- Сравнить спектр излучения неизвестного образца и стронция. Сделать вывод о том, присутствует ли стронций в составе образца.
- Сравнить спектр излучения неизвестного образца и кальция. Сделать вывод о том, присутствует ли кальций в составе образца.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
- Выбрать подходящее утверждение.
Решение
Если спектр излучения неизвестного образца содержит все линии, которые есть на спектре излучения известного элемента, то этот образец содержит данный элемент.
Видно, что спектр излучения неизвестного образца включает в себя все линии, которые есть в спектре излучения стронция. Но линий, соответствующих спектру излучения кальция, в нем нет. Следовательно, этот образец не содержит кальций.
Кроме линий, соответствующих стронцию, на спектре излучения неизвестного образца наблюдаются другие линии. Следовательно, он содержит как минимум еще один элемент.
Из всех перечисленных утверждений верным является только одно — образец не содержит кальция.
Источник: spadilo.ru
Оптические спектры Спектры испускания


а)
Cпектр испускания паров молекул иода

б)
Спектр испускания угольной дуги (полосы молекул CN и С2)
Спектры поглощения

400 450 500 550 600 700 (нм)
(5−солнечный; линейчатые: 6−натрия; 7−водорода; 8−гелия)
На рисунках 19.13 и 19.15 сопоставлены спектры испускания и поглощения разреженных паров натрия, водорода и гелия.
Изучая спектры испускания и поглощения атомов, еще в 19 веке физики пришли к выводу, что атом не является неделимой частицей, а обладает некоторой внутренней сложной структурой.
Использование линейчатых спектров лежит в основе спектрального анализа – метода исследования химического состава веществ по их спектрам. Отдельные линии в спектрах различных элементов могут совпадать, но в целом спектр каждого элемента является его индивидуальной характеристикой. Спектральный анализ сыграл большую роль в науке.
Например, в спектре Солнца (1814) были открыты фраунгоферовы темные линии, происхождение которых объясняется следующим образом. Солнце, являясь раскаленным газовым шаром (Т ~ 6000 °С), испускает сплошной спектр. Солнечные лучи проходят через атмосферу Солнца (солнечную корону, температура которой ~(2000–3000) °С.
Корона поглощает из сплошного спектра излучение определенной частоты, а на Земле регистрируется солнечный спектр поглощения (рис. 19.15,5), по которому можно определить, какие химические элементы присутствуют в короне Солнца. По спектрам поглощения на Солнце были обнаружены все земные элементы, а также неизвестный ранее элемент, который назвали гелий. Через 26 лет (1894) открыли гелий на Земле. Благодаря спектральному анализу на Земле было открыто еще 25 химических элементов.
Более того, спектральный анализ Солнца и звезд показал, что входящие в их состав химические элементы имеются и на Земле, т.е. вещество Вселенной состоит из одного и того же набора элементов.
Из-за своей сравнительной простоты и универсальности спектральный анализ является основным методом контроля состава вещества в металлургии и машиностроении. С помощью спектрального анализа определяют химический состав руд и минералов как по спектрам испускания, так и по спектрам поглощения. Состав сложных смесей анализируется по молекулярным спектрам.
Контрольные вопросы:
1. Приведите формулу Бальмера и поясните ее физический смысл.
2. Почему из различных серий спектральных линий атома водорода первой была изучена серия Бальмера?
3. Какие серии спектральных линий вы знаете?
4. Чему равна частота излучения атома водорода, соответствующая коротковолновой границе серии Брэкета?
5. Нарисуйте и поясните схему энергетических уровней атома водорода.
6. Приведите схему опыта Резерфорда и поясните ее.
7. Что такое постулаты Бора? Каков их физический смысл? Как с их помощью объясняется линейчатый спектр атома?
8. Что такое стационарные орбиты? Как рассчитываются их радиусы?
9. Почему ядерная модель атома по Резерфорду оказалась несостоятельной?
10. Приведите схему опыта Франка и Герца и вольт-амперную характеристику, описывающую результат этого эксперимента.
11. Какие постулаты Бора были подтверждены опытами Франка и Герца?
12. Какие основные выводы можно сделать на основании опытов Франка и Герца?
13. Пользуясь моделью Бора, укажите спектральные линии, которые могут возникнуть при переходе атома водорода из состояний с n=3 и с n= 4.
14. Назовите виды спектров испускания. Охарактеризуйте условия получения каждого вида спектров.
15. Что такое спектр поглощения? Условия получения спектров поглощения.
16. Что лежит в основе спектрального анализа?
Источник: studfile.net
Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров

На данном видеоуроке мы с вами поговорим о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров. Рассмотрим два постулата Бора и узнаем, где и зачем применяется спектральный анализ.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров»
Мирозданье постигая, все познай, не отбирая:
Что — внутри, во внешнем сыщешь.
Так примите ж без оглядки
Мира внятные загадки.
В данной теме речь пойдёт о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров.
В прошлой теме говорилось о дисперсии света. Дисперсия света — это зависимость показателя преломления среды и скорости света в нем от частоты световой волны.
В 1664–1668 гг. Исаак Ньютон провел серию опытов по изучению солнечного света и причин возникновения цветов с помощью стеклянной призмы. При разложении с помощью трёхгранной призмы белого света, т.е. света в видимом диапазоне, содержащего длины волн в диапазоне 380—760 нм, возникает радужная полоска, которую Ньютон назвал спектром.
В настоящее время для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма (которые использовал Ньютон), уже недостаточны. Необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма. Рассмотрим схему устройства призменного спектрального аппарата.
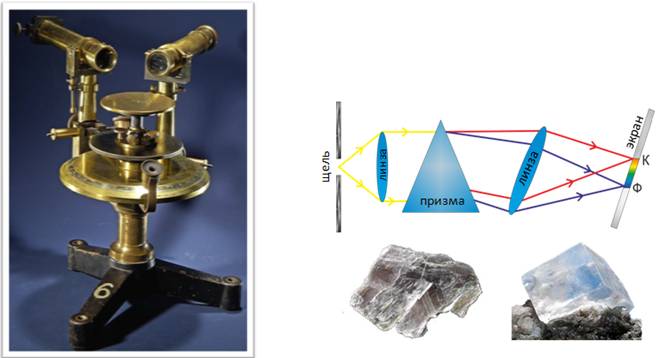
Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором. Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом — собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму, которая может быть изготовлена не только из стекла, но и кварца, соли и т.п.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран — матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений.
Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр. Описанный прибор называется спектрографом.
Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом.
Спектральный состав излучений различных веществ весьма различен. Но многочисленные наблюдения и фотографии спектров показывают, что все спектры можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
В опыте Ньютона, при пропускании солнечного света через призму, получали спектр в виде сплошной полосы. В ней были представлены все цвета, плавно переходящие один в другой. Такой спектр называется сплошным или непрерывным спектром.
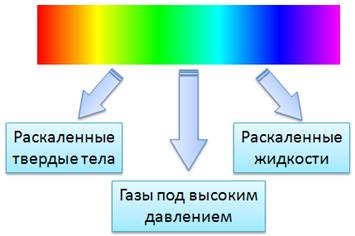
Сплошные спектры излучаются раскаленными твердыми и жидкими веществами, а также газами, находящимися под большим давлением. Это указывает на то, что вид непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом. Основную роль в излучении играет возбуждение атомов и молекул при хаотическом движении этих частиц, обусловленное высокой температурой. Солнце дает сплошной спектр, так как его оболочка состоит из плазмы высокой плотности.
Второй тип спектров — это линейчатые спектры.

Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
Например, если внести в пламя газовой горелки кусочек поваренной соли, то пламя окрасится в желтый цвет, а в спектре будут видны две близко расположенные желтые линии, характерные для спектра паров натрия.

Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину.
Такие спектры получаются от светящихся атомарных газов или паров. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Линейчатые спектры различных химических элементов отличаются цветом, положением и числом отдельных светящихся линий.
И последний тип спектров — это полосатые спектры.

Они состоят из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий.
Полосатые спектры излучаются отдельными возбужденными молекулами (молекулярный газ). Излучение вызвано как электронными переходами в атомах, так и колебательными движениями самих атомов в молекуле.
Все описанные выше спектры называются спектрами испускания, т.е. спектрами, получаемыми при разложении света, излученного самосветящимися телами.
Однако, кроме спектров испускания, существуют еще так называемые спектры поглощения.
Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии.

Спектры поглощения твердых и жидких тел обычно имеют вид широких темных полос, закрывающих часть сплошного спектра источника, а в случае атомарных газов или паров они состоят из отдельных черных линий, видимых на фоне сплошного спектра. Пропустив, например, свет от электрической лампы через сосуд с парами натрия, мы получим на сплошном спектре лампы две узкие черные линии в желтой области спектра как раз в том месте, где располагаются желтые линии в спектре испускания натрия. Другими словами, линии поглощения атомов натрия точно соответствуют его линиям испускания.
Совпадение частот линий испускания и поглощения можно наблюдать и в спектрах других элементов, например водорода и гелия.
В 1859 году на основе экспериментальных данных немецкий ученый Густав Роберт Кирхгоф сформулировал закон обратимости спектральных линий: линии поглощения соответствуют линиям испускания, т.е. атомы менее нагретого вещества поглощают из сплошного спектра как раз те частоты, которые они в других условиях испускают.
Спектр атомов каждого химического элемента уникален. Как не бывает двух людей с одинаковым дактилоскопическим узором, или окраской радужной оболочки глаз, или двух китов с одинаковой окраской хвостового плавника, так и не существует двух химических элементов, атомы которых излучали бы одинаковый набор спектральных линий.
Благодаря этому стало возможным появление метода спектрального анализа, разработанного в 1859 году Кирхгофом и его соотечественником немецким физиком Бунзеном. Спектральным анализом называют метод исследования химического состава различных веществ по их спектрам.
Анализ, проводимый по спектрам испускания, называют эмиссионным, а по спектрам поглощения — абсорбционным спектральным анализом.

В основе эмиссионного спектрального анализе лежат следующие факты:
1) Каждый элемент имеет свой спектр (отличается числом линий, их расположением и длинами волн), который не зависит от способов возбуждения.
2) Интенсивность спектральных линий зависит от концентрации элемента в данном веществе.
Спектральный анализ выгодно отличается от химического анализа своей простотой, высокой чувствительностью, а также возможностью определять химический состав отдаленных тел, например звезд. Он используется для контроля состава вещества в металлургии, машиностроении и атомной индустрии. Этот метод применяется также в геологии, археологии, криминалистике и многих других сферах деятельности.В астрономии методом спектрального анализа определяют химический состав атмосфер планет и звезд, температуру звезд и магнитную индукцию их полей.

В процессе изучения и применения линейчатых спектров возникли различные вопросы, которые нельзя было объяснить в рамках классической механики Ньютона. Как, например, объяснить, почему атомы каждого химического элемента имеют свой строго индивидуальный набор спектральных линий? Почему совпадают линии излучения и поглощения в спектре данного элементы?
Чем обусловлены различия в спектрах атомов разных элементов? Ответы на эти и многие другие вопросы удалось найти только в начале ХХ в. благодаря возникновению новой физической теории — квантовой механики. Одним из основоположником этой теории был датский физик Нильс Бор. Бор пришел к заключению, что свет излучается атомами вещества. В связи с этим в 1913 г. он сформулировал два постулата:
Первый постулат (его еще называют постулатом стационарных состояний) гласит, что атомная система может находиться только в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны не излучают электромагнитные волны, несмотря на ускоренное движение. В каждом стационарном состоянии атом обладает определенным квантовым значением энергии.
Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.
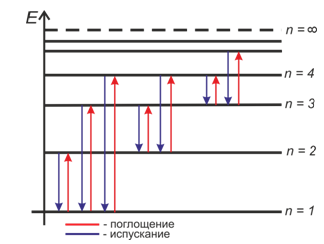
Атомы излучают и поглощают энергию дискретными порциями — квантами, значение которых равно разности энергии тех стационарных состояний, между которыми происходит данный переход.
Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным. Все другие состояния атома называются возбужденными. У атомов каждого химического элемента имеется свой характерный набор энергетических уровней. Поэтому переходу с более высокого энергетического уровня на более низкий будут соответствовать характерные линии в спектре испускания, отличные от линий в спектре другого элемента.
Совпадение линий излучения и поглощения в спектрах атомов данного химического элемента объясняется тем, что частоты волн, соответствующих этим линиям, а спектре, определяются одними и теми же энергетическими уровнями. Поэтому атомы могут поглощатьсвет только тех частот, которые они способны излучать.
Основные выводы:
– Все спектры испускания можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
– Сплошной спектр. Сплошной спектр представляет собойсплошную полосу, в которой все цвета, плавно переходят один в другой.
– Линейчатый спектр. Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
– Полосатый спектр. Полосатый спектр состоит из отдельных полос, разделенных темными промежутками.
– Для изучения спектров использую специальные приборы, которые называются спектральными — это приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра.
– Из опыта следует, что атомы могут поглощать свет только тех частот, которые они способны излучать. Это утверждение носит название закона обратимости спектральных линий.
– Спектральный анализ — это метод исследования химического состава различных веществ по их спектрам.
– В процессе изучения и применения линейчатых спектров возникли различные вопросы, ответы на которые дал Нильс Бор в 1913 году, сформулировав два постулата.
– Первый постулат (постулат стационарных состояний) гласит, что атомная система может находиться только в особых стационарных состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
– Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.
Источник: videouroki.net