Угольные грелки.
Еще лет 90 назад изобретательская мысль обратилась к самому распространенному экзотермическому процессу — реакции горения. Появились устройства , в которых тлеющий угольный стержень, обернутый в специальную бумагу был помещен в металлический корпус, а последний в суконный чехол . Такие грелки весили сравнительно немного , а действовали 5-6 часов . На поверхности корпуса температура была от 60 до 100 градусов Цельсия .
С + О2 —> CО2 + 94 ккал/моль
Каталитические грелки.
Во время первой мировой войны в окопах мерзли миллионы солдат, и за четыре военных года изобретатели США , Японии и Англии запатентовали несколько вариантов карманных жидкостных грелок . Принцип их действия был прост: каталитическое беспламенное окисление спирта или бензина . Катализатором во всех случаях служила платина. Японская грелка выглядела как портсигар, внутри которого были резервуар, набитый ватой и платиновая прокладка.
В корпусе были просверлены отверстия для подачи воздуха к катализатору и отвода газообразных продуктов горения. Для запуска грелки в резервуар заливался спирт, который пропитывал вату. Затем катализатор прогревали пламенем спички и начиналась реакция. Основной недостаток каталитических грелок — ограниченный срок службы: примеси, содержащиеся в горючем быстро отравляют катализатор и греющий портсигар становится бесполезным.
Химическая грелка своими руками. Как это устроено?
СаО + Н2 О —> Ca(OH)2 + 10.6 ккал.
2Са(ОН)2 + Н2С2О4 + 2 Н2О —> CаС2О4 + 4Н2О + 31 ккал
С помощью этих двух реакций можно в портативном устройстве получить температуру от 100 до 300 градусов Цельсия . Кроме того , использование кристаллогидратов кислот позволяет запускать грелку небольшим количеством воды, а с очередными порциями извести будет реагировать вода, выделяющаяся при нейтрализации.
Грелки, использующие реакции окисления металлов.
В обычных условиях коррозия металлов на воздухе протекает, к счастью, медленно. Присутствие солей резко ускоряет процесс. В конце 20-х годов для обогрева бойцов Красной Армии была рекомендована «железная» грелка — в мешочек из прорезиненной ткани помимо железных опилок помещали перманганат калия и наполнители — уголь и песок. После добавления воды на поверхности грелки в течение 10-20 часов поддерживается температура 100 градусов Цельсия.
4Fe + 2H2 O + 3O2 —> 2(Fe2O3 * H2O) + 390.4 ккал/моль
Вместо железа в коррозионных грелках лучше применять алюминий. Тепла в этой реакции выделяется гораздо больше, чем при окислении железа :
8Аl + 3Fe3O4 —> 4Al2O3 + 9Fe + 795 ккал/моль
Грелки, использующие реакции вытеснения металлов.
В 1940 году в СССР был разработан обогревательный пояс — обтянутый кожей медный резервуар, который крепился на брючном ремне. В резервуар засыпали 200 г. реакционной смеси — алюминиевого порошка хлористой меди , взятых в стехиометрическом соотношении . Воду в количестве 100-120 мл. добавляли в резервуар из баллончика, находящегося в нагрудном кармане.
Подачу воды регулировало несложное тепловое реле. Пояс мог согревать в течение 8 часов. Эта химическая грелка была новой не только по форме, но и по содержанию: впервые было использовано тепло, возникающее при вытеснении одного металла другим — более электроотрицательным. В Ленинграде, в блокадную зиму 1942 года , использовали грелки, заполненные смесью хлористой меди и железных стружек. От одной заправки водой такие грелки работали 60-70 часов.
Кристаллизационные грелки.
В кристаллизационных грелках используются вещества с низкими температурами плавления и относительно высокими теплотами плавления. Подобный термоаккумулятор отдает тепло, которое высвобождается при кристаллизации или затвердевании предварительно нагретого и расплавленного вещества. Классическое рабочее тело грелок-аккумуляторов парафин.
Можно использовать также стеариновую кислоту, низко плавкие кристаллогидраты, например, глауберову соль Na2 SO4 * 10H2O или тригидрат ацетата натрия CH3COONa * 3H2O. Небольшие добавки к кристаллогидратам хлористого кальция, тиосульфита натрия или глицерина позволяют замедлить процесс кристаллизации и тем самым повысить продолжительность работы грелки. Грелка разогревается за 15 сек. до 55 °С и процесс выделения тепла продолжается 25-30 минут. Грелка обладает достаточно высокой теплоемкостью и еще минут 25-30 способна отдавать тепло в режиме остывания. Грелка кристаллизационного типа хороша, как лечебное и профилактическое средство при воспалительных процессах , для больных с различными формами радикулита, для тюбажа печени и других процедур в стационарных условиях (дома или в больнице).
Использование кристаллизационных грелок в чрезвычайных ситуациях в полевых условиях ограничено непродолжительностью режима тепловыделения грелок.
Основное достоинство грелок кристаллизационного типа — возможность многократного использования: для восстановления исходного состояния грелки достаточно прокипятить ее в воде в течении 15-20 минут.
ГРЕЛКА ИЗ ПРОБИРКИ
В походе, на рыбалке, особенно в непогоду часто возникает нужда обыкновенной грелке. Конечно, неплоха и обычная резиновая, но у нее есть один существенный недостаток: очень уж медленно греется для нее на костре вода.
Попробуем сделать химическую грелку. Для этого нам понадобятся самые обычные реактивы.
Для начала проведем несложный опыт. Пойдите на кухню и возьмите пачку поваренной соли. Впрочем, пачка не понадобится. Достаточно будет 20 г (2 чайных ложки). Затем загляните в шкафчик, где хранятся всевозможные хозяйственные препараты и материалы. Наверняка там сохранилось после ремонта квартиры немного медного купороса.
Его понадобится 40 г (3 чайных ложки). Древесные опилки и кусок алюминиевой проволоки, надо полагать, тоже найдутся. Если так, все готово. Разотрите в ступке купорос и соль так, чтобы величина кристаллов не превышала 1мм (разумеется, на глаз). В полученную смесь добавьте 30 г (5 столовых ложек) древесных опилок и тщательно перемешайте.
Кусок проволоки согните спиралью или змейкой, вложите в банку из-под майонеза. Туда же засыпьте подготовленную смесь так, чтобы уровень засыпки был на 1-1.5 см ниже горлышка банки. Грелка у вас в руках. Чтобы привести ее в действие, достаточно влить в банку 50 мл (четверть стакана) воды. Спустя 3-4 минуты температура грелки поднимется до 50-60° С.
Откуда берется в банке тепло, и какую роль играет каждый из компонентов? Обратимся к уравнению реакции:
В результате взаимодействия медного купороса с поваренной солью образуется сульфат натрия и хлорная медь. Именно она нас интересует. Если вычислить тепловой баланс реакции, то окажется, что при образовании одной грамм-молекулы хлорной меди выделяется 4700 калорий тепла. Плюс теплота растворения в исходных образующихся препаратов — 24999 калорий. Итого: примерно 29600 калорий.
Тотчас же после образования хлорная медь вступает во взаимодействие с алюминиевой проволокой:
При этом выделяется (также в пересчете на 1 г-моль хлорной меди) примерно 84000 калорий.
Как видите, в результате процесса суммарное количество выделяющегося тепла превышает 100000 калорий на каждую грамм-молекулу вещества. Так что никакой ошибки или обмана нет: грелка самая настоящая.
А что же опилки? Не принимая никакого участия в химических реакциях, они в то же время играют очень важную роль. Жадно впитывая в себя воду, опилки замедляют течение реакций, растягивают работу грелки во времени. К тому же древесина обладает достаточно низкой теплопроводностью: она как бы аккумулирует выделяющееся тепло и затем постоянно отдает его. В плотно закрытой посуде тепло сохраняется, по меньшей мере, два часа.
И последнее замечание: банка, конечно, не лучший сосуд для грелки. Она понадобилась нам только для демонстрации. Так что сами подумайте над формой и материалом для резервуара, в который поместить греющую смесь.
Источник: govorilkin.livejournal.com
Самодельное тепло: химическая грелка своими руками
Реакция гашения соды знакома каждой домохозяйке, а учителя обожают демонстрировать эффектный «химический вулкан», который возникает при этом взаимодействии. Итак, как это сделать?
Роман Фишман

Пищевая сода (бикарбонат натрия) весьма охотно реагирует с уксусной кислотой, образуя соль (ацетат натрия) и слабую углекислоту, которая тут же диссоциирует на углекислый газ и воду. Все компоненты и продукты реакции вполне безвредны, а насыщенная газом смесь активно пенится, делая пироги пышнее и заставляя школьников удивленно показывать пальцем.
0 РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
CH3COOH + NaHCO3 → CH3COONa + H2CO3 H2CO3 → H2O + CO2 Ацетат натрия находит самое широкое применение не только в качестве пищевой добавки (Е262), но и в химической промышленности — при окрашивании тканей, вулканизации резины — и, конечно, в составе согревающих «солевых грелок». Это вещество плавится при температуре около 58 °C и легко растворяется в воде, а если затем выпарить из него лишнюю влагу и остудить, можно получить перенасыщенный раствор, ждущий лишь легкого «толчка» для того, чтобы моментально кристаллизоваться. Этот экзотермический процесс сопровождается выделением большого количества энергии — от 264 до 289 кДж/кг. В отличие от получения ацетата натрия, это не химическая реакция, а физический процесс, фазовый переход, и он вполне обратим. Стоит нагреть смесь (например, на водяной бане), ацетат снова растворится в остатках воды, и «грелку» можно использовать повторно.
0 РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Коротко ознакомившись с теорией, перейдем к практическим занятиям. Конечно, «солевую грелку» можно купить почти в любой аптеке, а готовый ацетат натрия — в первом же подходящем магазине химических реактивов. Но зачем? Все нужные ингредиенты можно найти на собственной кухне.
Источник: www.techinsider.ru
Как сделать многоразовый химический карманный обогреватель который нагревается за секунды

Для обогревателя нужен ацетат натрия. Он имеется в свободной продаже в магазине химических реактивов. Также реагент можно получить в домашних условиях из пищевой соды и уксуса (https://sdelaysam-svoimirukami.ru/3813-goryachiy-led.html). Из обычного ацетата натрия нужно сделать трехводный. Для этого на 82 гр. кристаллов заливается 54 гр. воды.

Трехводный ацетат натрия помещается в зип пакет. Он закрывается и опускается в кипящую воду, где варится 10-15 мин. Необходимо расплавить все кристаллики, для этого содержимое пакетов нужно периодически перемешивать.

Пакетик с расплавленным ацетатом необходимо извлечь и дать ему остыть. Хотя вещество замерзает при +58°С, но этого не произойдет, так как в нем нет центров кристаллообразования. В дальнейшем, если кинуть в грелку один кристаллик ацетата натрия, и закрыт пакет, то вещество мгновенно превратится в горячий лед. Он нагреется почти до +60°С, и будет оставаться теплым 20-30 мин.
Держа в запасе пару пакетиков и кристалликов для активации, можно в любой момент согреть руки. Чтобы перезапустить использованную грелку, ее нужно снова сварить в кипятке и потом для активации окунуть кристалл.

Смотрите видео
Источник: sdelaysam-svoimirukami.ru
Изготовление химической грелки
В зимнем походе или путешествии по северным районам так приятно согреться от постороннего источника тепла. Но костер можно развести только на привале или во время длительной стоянки, а что же делать в движении? Тут может помочь химическая грелка, которая является необходимым атрибутом в наборах для выживания.
Конечно, ее можно приобрести в специализированных магазинах, но это будет стоить не так дешево, как хотелось бы, поэтому лучше остановиться на самодельном устройстве. В зависимости от того, как вы хотите ее применять: для согревания рук, тела под одеждой или как грелку в спальник, выбирается и емкость, в которой будет протекать химическая реакция.
Существует несколько способов изготовления химической грелки, но мы остановимся на трех, наиболее распространенных. Для начала определимся с ингредиентами, которые я изобразил на рисунке.
Способ 1 (более старый)
Для первого способа вам понадобятся: 20 г обыкновенной соли (NaCl), 40 г медного купороса (CuCl), кусок алюминиевой проволоки и 30г древесных опилок. Купорос и соль желательно измельчить до размера кристаллов не более 1 мм (если они крупнее).
В смесь соли и медного купороса добавьте древесные опилки и тщательно перемешайте. Алюминиевую проволоку согнуть спиралью и вложить в баночку или бутылочку (желательно стеклянную). Сверху засыпать приготовленную смесь, чтобы уровень был на 1см ниже горлышка. Для приведения в рабочее состояние достаточно добавить в емкость 50 мл воды, которая запустит реакцию и поднимет температуру вашей грелки до 60°С через 3-4 минуты.
Чтобы понять принцип действия, я приведу формулу химической реакции:
Именно образование хлорной меди приводит к выделению части тепла, основное же тепло возникает при ее взаимодействии с алюминиевой проволокой:
Древесные опилки не принимают участия в химической реакции. Впитывая воду, они являются своеобразным замедлителем реакции, что значительно продлевает время работы грелки. К тому же древесина обладает низкой телопроводностью, что позволяет ей накапливать тепло и отдавать его постепенно. В закрытой емкости тепло удерживается до 2 часов.
Для современных реалий, стеклянная тара – это что-то раритетное. Гораздо проще найти пластиковую емкость подходящей формы и объема. В таком случае побеспокойтесь о том, чтобы проволока не прикасалась к пластику, так как при нагревании он может покоробиться.
Такая конструкция химической грелки востребована у туристов, которые устраивают зимние ночевки в палатках. Они берут ее с собой в спальник и размещают за пазухой, чтобы согреться перед сном.
Чтобы ее сделать понадобится плотный непромокаемый пакет (опытные берут 2 – один в одном), в который засыпается смесь из 5 г порошка CuCl, 5 г алюминиевого порошка и 5 слоловых ложек древесных опилок. Достаточно добавить в такую смесь 40 мл воды, чтобы началась химическая реакция с выделением тепла.
Этот способ во многом напоминает первый. Только в данном случае мы не применяем опилки.
Вначале берем кусок алюминиевой фольги 20х30 см. Складываем его вдвое (10х30 см) и сворачиваем в трубочку вокруг деревянной шпажки для барбекю. После этого шпажку приклеиваем к крышке пластиковой бутылочки клеевым пистолетом. Так нагревающуюся фольга не будет касаться пластиковых стенок.
Берем пищевую соль и порошок медного купороса в соотношении 1:2 и засыпаем их в бутылку. Для начала реакции надо добавить в емкость воды. В процессе реакции будет выделяться тепло и водород, который придется стравливать время от времени. Алюминиевая фольга будет растворяться, поэтому бутылку надо периодически встряхивать. Об окончании реакции, а соответственно и прекращении тепловыделения, вы узнаете по прекращению выделения газа на фольге.
Как видите, приведенные мною способы имеют свои плюсы и минусы, так что выбирайте тот, который вам больше подходит для походов и местных условий выживания.
Основное меню
- Главная
- Снаряжение
- Навыки
- Постройка убежища
- Обеспечение пищей
- Природные медикаменты
- Ориентирование на местности
- Обеспечение одеждой и снаряжением
- Навыки выживания
Источник: www.survival-equipment.ru
Химическая грелка своими руками




Долгополов, Е. В. Химическая грелка своими руками / Е. В. Долгополов, Т. Ф. Мамедов, Е. В. Исавнина. — Текст : непосредственный // Юный ученый. — 2020. — № 5 (35). — С. 53-55. — URL: https://moluch.ru/young/archive/35/2035/ (дата обращения: 25.11.2022).
Практически каждый ребенок зимой сталкивался с такой проблемой, как замершие руки, даже если на них надеты самые теплые варежки. Чтобы не допустить переохлаждения и обморожения можно использовать специальные грелки, которые можно приобрести на прилавках специализированных магазинов. Любители активного зимнего отдыха могут и самостоятельно изготовить грелку для рук с использованием самых простых реактивов.
Цель работы: изготовить химическую грелку своими руками.
- Узнать процесс изготовления химической грелки.
- Подобрать подходящие реактивы и емкость для изготовления грелки.
- Испытать действие химической грелки на улице в морозных условиях.
Химическая грелка — устройство очень простое [1, 2]. Обычно это емкость из водонепроницаемого и химически стойкого материала. Внутри емкости — смесь веществ (реактивы):
- Медный купорос (сульфат меди)
- Поваренная соль (хлорид натрия)
- Алюминий
Чтобы грелка начала работать, к веществам надо добавить немного воды и все перемешать. Емкость с содержимым закрывают и встряхивают. После этого необходимо открыть крышку и отставить в сторону для выхода паров. Как реакция окисления стихнет, емкость закрывается и можно греть руки. В грелке протекает химическая реакция, которая сопровождается выделением тепла.
Для того, чтобы продлить работу грелки можно добавить опилки. В закрытой емкости тепло удерживается до двух часов. Чтобы использовать грелку повторно достаточно через несколько часов добавить в нее воды. Этого самодельного приспособления точно хватит для обогрева рук в течение всего времени нахождения на прогулке. После этого грелку утилизируют вместе с бытовым мусором, а отправляясь на следующую прогулку, можно быстренько соорудить новое тепловое устройство.
Для изготовления грелки для рук необходимы:
- Посуда и оборудование: флакон 200 мл.-1шт, разовые стаканчики — 2 шт, ложка-1шт, воронка- 1шт, разовая тарелка-1шт, мерный стаканчик-лейка, отвертка -1шт, термометр- 1шт.
- Реактивы: медный купорос (сульфат меди)- 40 грамм, соль поваренная (хлорид натрия)- 20 грамм, алюминиевая проволока или ложка (часть), вода — 50мл, древесные опилки-30 граммов (5 столовых ложек). Фото 1
Примечание: соли в одной столовой ложке 30 грамм, а в одной чайной ложке-10 грамм

Изготовление грелки для рук подручным способом [3] состоит из следующих шагов:
Шаг 1: Провод сворачивается спиралью, диаметр которой зависит от горлышка тары (спираль должна свободно помещаться во флакон).
Шаг 2: С помощью отвертки спираль растягивается по всей длине бутылочки.
Шаг 3: Подготавливается начинка грелки путем перемешивания соли и медного купороса.
Шаг 4: На 200 мл флакона засыпается 2 столовые ложки подготовленной смеси из медного купороса и поваренной соли.

Шаг 5: Во флакон вставляется спираль и добавляется вода.
Шаг 6: Емкость с содержимым закрывают и встряхивают. После этого необходимо открыть крышку и отставить в сторону для выхода паров.
В грелке протекает химическая реакция, которая сопровождается выделением тепла. Спустя 3 минуты температура внутри грелки поднялась. При помощи термометра смогли определить температуру +55 ° С.
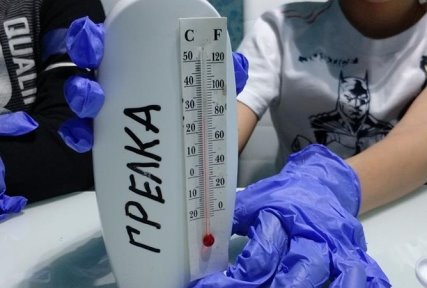
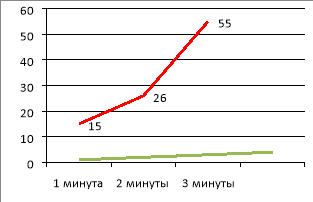
Рис.4. График изменения температуры
График показывает, что с каждой минутой температура росла.
Как только реакция окисления стихнет, емкость закрывается и можно греть руки. Для того, чтобы продлить работу грелки, можно добавить древесных опилок. Никакого участия в химических реакциях, они не принимают, но играют очень важную роль. Жадно впитывая в себя воду, опилки замедляют течение реакций, растягивают работу грелки во времени. В плотно закрытой посуде тепло сохраняется, по меньшей мере, два часа.
- Перед началом опыта наденьте защитные перчатки и очки.
- Соблюдайте общие правила безопасности.
- При необходимости умей оказать первую помощь.
В походных условиях грелка тоже собирается легко. Достаточно воспользоваться бутылкой, которая осталась из-под лимонада или минеральной воды. Соль, обязательно окажется в рюкзаке, ведь надо же чем-то солить пищу. От алюминиевой ложки, при необходимости можно открутить какую-то ее часть. Получается, что с собой из дома нужно захватить лишь медный купорос.
Химическую грелку для рук можно изготовить самостоятельно. Для изготовления грелки требуются вещества, которые не причиняют вред человеку. Изготовление такой грелки выгодно, так как не несет особых финансовых затрат.

- [Электронный ресурс]: http://firstfisher.ru/oborudovanie/izgotavlivaem-grelku.html
- [Электронный ресурс]: http://izobreteniya.net/opasna-li-himicheskaya-grelka-i-kak-ee-sdelat-svoimi-rukami/
Основные термины (генерируются автоматически): медный купорос, химическая грелка, изготовление грелки, работа грелки, грелка, рука, химическая реакция, выделение тепла, выход паров, реакция окисления.
Похожие статьи
Экспериментальные исследования органических химических.
Одним из признаков протекания химических реакций является излучение света в процессе
Известно, что яркое свечение, отчетливо заметное глазу, наблюдается при окислении
Рис. 1. Подготовка к проведению экспериментов по изучению органических химических реакций с.
Особенности обезвоживания кристаллогидратов в микроволновом.
Она включает химические превращения с участием твердых диэлектриков и жидкостей
Специфика работы с солями повышенной чистоты требует исключения возможности контакта с
Ход работы. Поместить в один стакан с водой несколько кристаллов медного купороса.
Химия в домашних условиях. Чудеса на кухне | Статья в журнале.
Познакомиться с характеристикой химических веществ, их свойствами, химическими
Нужно быть очень внимательным, т. к. эта реакция идет с выделением тепла, раствор
В своей работе я делала упор, на то, что химический эксперимент, доступен и в домашних условиях.
Эффективность охлаждения газов в пенном слое на провальных.
Используются диффузионная и ячеечная модели с объемными источниками тепла. Представлены решения уравнений этих моделей для различных частных случаев теплообмена на тарелках. Даны результаты расчетов и сравнение с опытными данными.
Химическая радуга | Статья в журнале «Юный ученый»
Новизна Практическим путем осуществлена последовательность химических реакций в одной колбе в порядке цветов радуги.
Марганец, хром и ванадия являются «химическими хамелеонами», способными изменять окраску при переходе в различные степени окисления.
Синтез органических производных меди (II) | Статья в журнале.
Поэтому нами была поставлена цель: изучить реакции синтеза некоторых органических производных двухвалентной меди.
Стартовым соединением меди послужил также легкодоступный и устойчивый медный купорос — пятиводный кристаллогидрат сульфата меди.
Влияние капиллярно-пористых структур на интенсификацию.
В ряде отраслей техники режимы работы испарителей характеризуются чрезвычайно низкими температурными напорами и, соответственно, очень малыми плотностями теплового потока. Это относится к конденсаторам-испарителям воздухоразделительных установок, к испарителям.
Электромагнитное излучение и химические реакции
Целью данной работы является изучение влияния электромагнитного излучения (ЭМИ) мм- диапазона на изотропные водные растворы салициловой кислоты и ее комплексов с железоаммонийными квасцами. Приводятся результаты данного взаимодействия.
Вода и ее химические свойства | Статья в журнале «Юный ученый»
Понять воду, значит понять Вселенную. Масару Эмото (1943–2014), японский исследователь. Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет.
Источник: moluch.ru