Берём 10 литров допустим 36% раствора, тогда в нём содержится 3,6 литра кислоты. Доливаем х л воды (можно из-под крана), чтобы концентрация получилась допустим 4% = 0,04.
Делим объём кислоты 3,6 л на полный объём нового раствора 10+х и получаем 0,04. Решаем уравнение 0,4 + 0,04х = 3,6; х = 80 л воды надо долить. Примерно вот такая плипорция!
Вам надо разбавить примерно в 10 раз. Берите 1 объем кислоты и 9 объемов воды. А если быть точным, то надо вспомнить определение процентной концентрации — это отношение массы растворенного вещества к массе раствора. Если верить таблице Б. 1 ГОСТ 857-95 «Кислота соляная синтетическая техническая. Технические условия», то при концентрации 37% плотность равна 1,185 кг/л.
Значит, кислоты там 1,185*0,37=0,438 кг.
Вам надо получить концентрацию примерно 3,5%. Тогда масса раствора должна быть 0,438/0,035=12,5 кг. Следовательно, воды надо долить 12,5-1,185=11,3 литра.
Рустам ИскендеровИскусственный Интеллект (132598) 2 года назад
Просмотрел ваше решение внимательно и не обнаружил в нём изъянов.
Рустам Искендеров Искусственный Интеллект (132598) Рустам Искендеров, Ан-нет, ошибся я. У вас верно.
Рустам ИскендеровИскусственный Интеллект (132598) 2 года назад
Хотя. Вы пишете: «. при концентрации 37% плотность равна 1,185 кг/л. Значит, кислоты там 1,185*0,37=0,438 кг».
А я рассуждаю так. При данной плотности литр раствора весит 1,185 кг. Из этого кол-ва х кг кислота, 1,185-х кг вода. Следовательно, х/(1,185-х) = 0,37. Отсюда х= 0,32 кг.
У вас же 0,438 кг.

J3QQ4-H7H2V-2HCH4-M3HK8-6M8VW . Мастер (2490) Рустам Искендеров, нет. Вспомните определение процентной концентрации — отношение массы вещества к массе РАСТВОРА (вода + вещество), или знакомую уже нам табличку: 37% соответствуют примерно (424,44+451,82)/2=438,13 г.
Я нашёл вроде ф-лу М0/(10р) -1, где М0 (г/л) — концентрация кислоты в первичном растворе, берётся из таблицы:
р0 *********М0
34%***397,46 г/л
36%***424,44 г/л
38%***451,82 г/л
р0 (%) — требуемый «процентаж».
Например, при р0= 35% имеем: М0= (397,46+424,44)/2= 410,95 г/л. Если требуется 2%-ный, то добавляется 410,95/(10*2)-1= 19,55 л воды;
при р0= 38% и р= 5% для добавочного объёма воды имеем: 451,82/(10*5)-1= 8,04 л.
J3QQ4-H7H2V-2HCH4-M3HK8-6M8VW .Мастер (2490) 2 года назад
Вы берете объемную концентрацию, а работают, как правило, с массовой. Кроме водки.
Рустам Искендеров Искусственный Интеллект (132598) Строго говоря, г/л — не объёмная концентрация, поскольку растворимое вещество взято в граммах. Я учёл также плотность кислоты (1,19 г/см3), приведённую в Википедии. Но кое-что и мне не нравится, будет время — посмотрю ещё раз.
J3QQ4-H7H2V-2HCH4-M3HK8-6M8VW .Мастер (2490) 2 года назад
А где вы взяли свою формулу? Меня смущает единица в конце. Там, все-таки, должна быть плотность исходного раствора, кг/л, а она чуть больше 1.
Рустам Искендеров Искусственный Интеллект (132598) Вывод долговатый, хотя могу привести. Но лучше всё обдумаю ещё раз, потом напишу вам.
Источник: otvet.mail.ru
Как развести кислоту
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 17 человек(а).
Количество просмотров этой статьи: 50 934.
В этой статье:
Для безопасности и простоты применения рекомендуется покупать максимально разбавленную кислоту, но иногда ее приходится разбавлять еще больше в домашних условиях. Не забудьте о защитных средствах для тела и лица, поскольку концентрированные кислоты вызывают сильные химические ожоги. Чтобы рассчитать необходимое количество кислоты и воды, вам нужно будет знать молярность (М) кислоты и молярность раствора, который вам нужно получить.
Метод 1 из 3:
Как рассчитать формулу

- В формуле также будет использоваться значение V1. Это объем кислоты, которую мы будем добавлять к воде. Скорее всего, нам не потребуется вся бутылка кислоты, хотя мы еще не знаем точное количество.

- Если вам даны другие единицы, для начала переведите их в единицы молярности (моль на литр) и литры.
- Если вы не знаете, какая нужна концентрация или объем кислоты, спросите у учителя или человека, хорошо разбирающегося в химии.

- Используя данные из примера, запишем эту формулу как (6M)(V1)=(2M)(0.5L).

- В нашем примере получится V1=((2M)(0.5L))/(6M). Это равняется приблизительно 167 миллилитрам.

- В нашем случае мы хотим получить 0.167 литров кислоты на 0.5 литра воды. Нам потребуется 0.5 литра — 0.167 литров = 0.333 литра, то есть 333 миллилитра.
Источник: ru.wikihow.com
Приготовление рабочего раствора соляной кислоты
Концентрированную соляную кислоту разводят до заданного для рабочего раствора содержания НСl на месте ее хранения (кислотная база) или непосредственно у скважины перед ее обработкой.Так как соляная кислота, поступающая с заводов, может иметь различную концентрацию, то необходимо точно рассчитать, какое количество воды и кислоты требуется смешать, чтобы получить раствор заданных концентрации и объема.
Количество товарной кислоты 1» в объемных единицах, необходимое для получения 1 м3 рабочего раствора заданной концентрации, рассчитывают по следующей формуле:
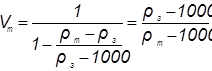
или для любого количества кубометров
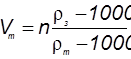
где 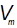 – объем товарной кислоты,
– объем товарной кислоты, 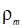 — плотность товарной кислоты, кг/м;
— плотность товарной кислоты, кг/м; 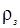 – заданная плотность готового раствора, кг/м;
– заданная плотность готового раствора, кг/м; 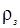 берут исходя из заданного процентного содержания НСl в рабочем растворе. Для приготовления раствора заданной концентрации НСl товарную кислоту разводят в емкостях, объем которых строго протарирован. Соответственно расчету, в емкость заливают воду, затем заливают концентрированную товарную кислоту и летом вносят все необходимые добавки (ингибиторы, ПАВ и пр.). Добавки реагентов-ингибиторов, ПАВ обычно настолько незначительны, что поправки на объемы этих реагентов не вводятся.
берут исходя из заданного процентного содержания НСl в рабочем растворе. Для приготовления раствора заданной концентрации НСl товарную кислоту разводят в емкостях, объем которых строго протарирован. Соответственно расчету, в емкость заливают воду, затем заливают концентрированную товарную кислоту и летом вносят все необходимые добавки (ингибиторы, ПАВ и пр.). Добавки реагентов-ингибиторов, ПАВ обычно настолько незначительны, что поправки на объемы этих реагентов не вводятся.
Источник: studopedia.ru
КАЛЬЦИМЕТРЫ

По плотности могут быть установлены значения концентрации исходной кислоты и ее водных растворов (таблица 1, таблица 2).
При отсутствии ареометров плотность ρ(г/см 3 ) рассчитывают по массе m(г) известного объема кислоты V(см 3 ), измеренной на электронных весах: ρ = m/V.
Отбор кислоты удобно и безопасно осуществлять в полипропиленовый шприц со шкалой 20 мл плавным перемещением поршня до упора.
Объем V соответствует полному заполнению шприца. Для определения этого объема положите сухой шприц на чашу весов и обнулите вес тары (или запишите значение массы пустого шприца). Заполните весь объем шприца дистиллированной водой, не допуская попадания пузырьков воздуха, тщательно вытрите поверхность шприца и произведите его повторное взвешивание.
Принимая значение плотности воды ρв = 0,998 г/см 3 (при 20 °C), определите объем шприца
V = mв / 0,998, где mв – масса воды (г).
Затем полностью заполните шприц имеющимся раствором кислоты, измерьте массу раствора и рассчитайте плотность кислоты по приведенной выше формуле. Если полученное значение плотности меньше 1,174 г/см 3 , концентрированная кислота не соответствует требованиям ГОСТ 3118-78, либо разбавлена водой.
Пример.
Кислота отобрана в шприц, полный объем которого V = 24,6 см 3 . Масса кислоты, измеренная на электронных весах, m = 29,175 г.
Следовательно, расчетное значение плотности ρ = 29,175 / 24,6 = 1,186 г/см 3 .
2. Определение концентрации водных растворов соляной кислоты.
Концентрация растворов соляной кислоты может выражаться в виде процентного содержания HCL в массе раствора, в виде объемного соотношения долей концентрированной кислоты и воды в растворе, а также в виде количества молей вещества в литре раствора.
Концентрация раствора определяется по плотности с помощью значений, приведенных в справочных таблицах.
Пример.
Масса раствора соляной кислоты объемом 24,6 см 3 равна 26,2 г. Необходимо определить, в каком объемном соотношении концентрированная кислота смешана с водой, исходную концентрацию, а также весовую и молярную концентрацию (нормальность) раствора.
По расчетному значению плотности раствора ρ = 26,2/24,6 = 1,065 г/см 3 определите с помощью таблицы 3 объемные доли HCL и воды (1:2) и исходную концентрацию кислоты, из которой был приготовлен раствор (36,5% вес.).
Затем,используя таблицу 4, найдите для раствора плотностью 1,065 г/см 3 интерполированием значений молярную концентрацию:
3,881 + (4,004 – 3,881)·(36,5 – 36,0) = 3,942 моль/л
Затем по таблице 5 определите весовую концентрацию раствора:
13,30 + (13,69 – 13,30)·(36,5 – 36,0) = 13,49 % вес.
3. Приготовление водных растворов соляной кислоты в заданном объемном соотношении.
Для приготовления растворов необходимо использовать соляную кислоту по ГОСТ 3118-78 с весовой концентрацией от 35 до 38 % вес. (таблица 1).
Если концентрация кислоты не известна, определите ее по плотности.
Приготовление раствора нужно осуществлять добавлением объема концентрированной кислоты в заданный объем дистиллированной воды, соблюдая требования техники безопасности. Используйте для приготовления раствора соответствующую емкость. Работайте под вытяжкой.
Пример.
Для приготовления 500 мл раствора в объемном соотношении 1:4 необходимо 100 мл концентрированной кислоты аккуратно влить в 400 мл дистиллированной воды, тщательно перемешать и перелить раствор в емкость из темного стекла с герметичной крышкой.
4. Приготовление водных растворов соляной кислоты требуемой весовой концентрации.
Для приготовления раствора необходимо смешать расчетные количества кислоты известной концентрации и дистиллированной воды.
Пример.
Необходимо приготовить 1 л раствора HCL концентрацией 6 % вес. из соляной кислоты концентрацией 36 % вес. (такой раствор используется в карбонатомерах КМ производства ООО НПП «Геосфера»).
По таблице 2 определите молярную концентрацию кислоты с весовой долей 6 % вес.(1,692 моль/л) и 36 % вес.(11,643 моль/л).
Рассчитайте объем концентрированной кислоты, содержащей такое же количество HCl (1.692 г-экв.), что и в приготавливаемом растворе:
1,692 / 11,643 = 0,1453 л.
Следовательно, добавив 145 мл кислоты (36 % вес.) в 853 мл дистиллированной воды, получите раствор заданной весовой концентрации.
5. Приготовление водных растворов соляной кислоты заданной молярной концентрации.
Для приготовления раствора с нужной молярной концентрацией (Mp) необходимо один объем концентрированной кислоты (V) влить в объем (Vв) дистиллированной воды, рассчитанный по соотношению
Vв = V(M/Mp – 1)
где M – молярная концентрация исходной кислоты.
Если концентрация кислоты не известна, определите ее по плотности, используя таблицу 2.
Пример.
Весовая концентрация используемой кислоты 36,3 % вес. Необходимо приготовить 1 л водного раствора HCL с молярной концентрацией 2,35 моль/л.
По таблице 1 найдите интерполированием значений 12,011 моль/л и 11,643 моль/л молярную концентрацию используемой кислоты:
11,643 + (12,011 – 11,643)·(36,3 – 36,0) = 11,753 моль/л
По приведенной выше формуле рассчитайте объем воды:
Vв = V (11,753 / 2,35 – 1) = 4·V
Принимая Vв + V = 1 л, получите значения объемов: Vв = 0,2 л и V = 0,8 л.
Следовательно, для приготовления раствора с молярной концентрацией 2,35 моль/л, нужно влить 200 мл HCL (36,3 % вес.) в 800 мл дистиллированной воды.
6. Расход соляной кислоты для определения карбонатности образцов горной породы.
Количество концентрированной кислоты, затрачиваемой на исследование образца, рассчитывается по следующим реакциям взаимодействия карбонатных веществ с учетом молекулярных весов (таблица 6) и молярной концентрации кислоты (таблица 2):
CaCO3 + 2HCL = CaCL2 + H2O + CO2
CaMg(CO3)2 + 4HCL = CaCL2 + MgCL2 + 2H2O + 2CO2
FeCO3 + 2HCL = FeCL2 + H2O + CO2
Наибольшее количество кислоты расходуется на разложение доломита, т.к. в 1 г CaMg(CO3)2 содержится 21,691 мг-экв., в 1 г CaCO3 – 19,982 мг-экв., а в 1 г FeCO3 – 17,262 мг-экв. Для полного разложения карбонатов необходимо израсходовать такое же количество мг-экв. HCL.
В 1 мл концентрированной соляной кислоты (35…38% вес.) содержится 11,267…12,381 мг-экв. (таблица 1). Поэтому на разложение 1 г доломита теоретически необходимо от 21,691 / 12,381 = 1,75 мл до 21,691 / 11,267 = 1,92 мл концентрированной кислоты (таблица 7).
При проведении исследований образцов горных пород расход концентрированной кислоты должен быть не менее 2 мл на 1 г карбонатных веществ. Избыток кислоты необходим для нормального протекания химической реакции.
Расчетные значения объема растворов кислоты, необходимого для взаимодействия 1 г карбонатов с кислотой, даны в таблице 8.
Расход водных растворов, содержащих оптимальный избыток соляной кислоты для полного разложения 1 г карбонатных пород, приведен в таблице 9.
Фактический объем раствора кислоты, расходуемой на исследование одного образца, устанавливает изготовитель карбонатомеров.
Для карбонатомеров серии КМ производства ООО НПП «Геосфера» расход концентрированной соляной кислоты на один образец составляет не более 2,35 мл.
7. Подготовка образца
Для получения навески массой 1000 мг нужно отобрать и измельчить не менее 3 г сухих флагментов керна или промытых и высушенных частиц шлама основной породы.
После измельчения образца необходимо просеять порошок через сито с размером ячеек 0,056 мм или 0,063 мм.
Если образец отобран из нефтенасыщенного керна или шлама, то после измельчения следует выполнить экстрагирование образца органическим растворителем (четыреххлористым углеродом CCl4 или хлороформом CHCl3).
Для экстрагирования просеянный порошок необходимо насыпать кучно на листок фильтровальной бумаги и с помощью пипетки нанести на него под вытяжкой 30…40 капель растворителя. После испарения растворителя из образца нужно отобрать навеску для взвешивания.
Взвешивание следует осуществлять на электронных весах не ниже 3 класса точности, имеющих дискретность отсчета не менее 1 мг. Взвешиваемый образец рекомендуется насыпать на подложку из плотной мелованной бумаги (для удобства последующей засыпки в контейнер реакционной камеры карбонатомера).
Следует учитывать, что неточное взвешивание образца увеличивает погрешность определения карбонатности. Например, при погрешности взвешивания ± 10 мг дополнительная ошибка определения карбонатности образца массой 500 мг составляет ± 2%.
8. Нейтрализация остатков соляной кислоты
После окончания реакции взаимодействия карбонатных веществ с кислотой в растворе остается определенное количество HCl, зависящее от карбонатности исследованного образца породы.
При содержании карбонатов в образце 100% вес. это количество соответствует избыточному объему HCl, введенному в раствор сверх расчетного количества кислоты, необходимого для разложения 1 г карбонатных веществ (таблица 7,8). Если карбонатность образца меньше 100 % вес., избыток HCl в растворе увеличивается на количество непрореагированной кислоты.
Для нейтрализации остатков HCl необходимо добавить в раствор равное количество мг-экв. одного из веществ, взаимодействующих с соляной кислотой (например, бикарбонат натрия NaHCO3, бикарбонат калия KHCO3, углекислый натрий Na2CO3, углекислый калий K2CO3, гидроокись натрия NaOH или гидроокись калия KOH).
Расчетное количество безводных веществ, затрачиваемых на нейтрализацию кислоты, содержащейся в 1 мл водных водных растворов HCl разной концентрации, приведено в таблице 10.
Количество вещества, используемого для нейтрализации остатков HCl после исследования образца породы массой 1 г, может быть определено исходя из объема раствора кислоты, не затраченной на реакцию.
Пример.
При исследовании образца породы массой 1 г, содержащего 85% кальцита, израсходовано 15 мл водного раствора HCl (1:6), приготовленного из кислоты с концентрацией 38% вес. Необходимо определить количество NaHCO3 для нейтрализации остатков HCl после реакции.
Расчетный объем раствора кислоты для разложения 1 г CaCO3 равен 11,3 мл (таблица 8).
Избыток раствора HCl составляет 15,0 – 11,3 = 3,7 мл.
Расчетное количество непрореагированной кислоты равно 11,3·(1 – 85/100) = 1,7 мл. Следовательно, необходимо нейтрализовать кислоту в растворе объемом 3,7 + 1,7 = 5,4 мл.
Используя таблицу 10, рассчитываем требуемое для нейтрализации количество безводного бикарбоната натрия 0,149 · 5,4 = 0,8 г.
Фактический расход безводных веществ, используемых для нейтрализации остатков кислоты в 1 мл раствора, больше расчетных значений (таблица 10) на величину
(100/C -1)%
где С – весовая доля чистого вещества в безводном порошке, % вес.
Пример.
Для нейтрализации кислоты, содержащейся в 1 мл разбавленного (1:6) раствора HCl с начальной концентрацией 38 % вес. согласно таблице 10 необходимо 0,099 г KOH.
Весовая доля KOH равна 88 % вес.
Фактическое количество вещества, затрачиваемого на нейтрализацию кислоты больше расчетного и равно
0,099 · 100/88 = 0,112 мг.
Из химических веществ, пригодных для нейтрализации соляной кислоты, наиболее доступным является бикарбонат натрия NaHCO3 по ГОСТ 2156-76 (он же двууглекислый натрий или пищевая сода).
Недостатком этого вещества является плохая растворимость в воде при нормальной температуре (8,8 г в 100 мл воды при 20°C), что не позволяет применять NaHCO3 в растворе с концентрацией более 8% вес.
При реакции NaHCO3 с соляной кислотой происходит выделение углекислого газа и паров раствора, поэтому нейтрализацию необходимо осуществлять в емкости объемом не менее 250 мл.
Кроме NaHCO3 для нейтрализации может быть рекомендована гидроокись калия KOH, которая хорошо растворяется в воде (до 112 г в 100 мл при 20°C) и реагирует с кислотой с образованием водорастворимой соли KCl.
При небольших концентрациях растворы NaHCO3 и KOH обладают слабощелочными свойствами и безопасны в применении.
9. Документация на карбонатомеры КМ (до 2005 года выпуска)
Источник: calcimeter.geosferatver.ru