Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
Получение серы

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.

Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
Золото из пирита. Самый быстрый способ!
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород — сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, в ходе которой образуется сульфид свинца.
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)

SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Сера
Источник: studarium.ru
FeS2 -> SO2 уравнение реакции
Укажите все возможные реакции, посредством которых из пирита можно получить диоксид серы (FeS2 -> SO2). Расскажите о физических и химических свойствах оксида серы (IV). Укажите основные сферы его применения.
Xumuk Админ. ответил 5 лет назад
Получение диоксида серы из пирита возможно (FeS2 -> SO2) посредством нижеуказанных реакций:
Диоксид серы – сернистый газ – синтезируют сжиганием серы на воздухе или окислением сульфидов, а также действием 70%-ной серной кислоты на сульфиты металлов:
Диоксид серы – бесцветный тяжелый токсичный газ с удушливым запахом. При температуре он сжижается. Жидкий сернистый ангидрид – бесцветная подвижная жидкость, хорошо растворяющая черу, йод, жиры.
Угловое строение и локализация электронной пары на атоме серы объясняют полярность молекулы и её высокую реакционную активность.
Сернистый газ хорошо растворим в воде (40 объемов в 1 объеме при , т.е. около 10% по массе) с образованием гидратов . Вследствие частичной диссоциации раствор приобретает кислую реакцию.
Для диоксида серы характерна окислительно-восстановительная двойственность. Так, сернистый газ обесцвечивает воду:
и раствор перманганата калия:
Источник: ru.solverbook.com
Получение серной кислоты из пирита
Процесс получения серной кислоты (H2SO4) из пирита (FeS2) протекает по следующим стадиям:
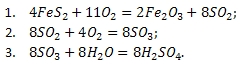
Запишем суммарное уравнение реакции:
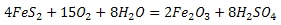
Хочу обратить ваше внимание на то, что если образование продукта, массу которого необходимо определить, идет через ряд промежуточных стадий, не целесообразно проводить расчет по каждой стадии. В таких случаях для расчета составляем стехиометрическую схему, которая включает исходный и конечный продукты с учетом их стехиометрических коэффициентов.
Решение по стехиометрической схеме нельзя применять в том случае, если исходное вещество расходуется на образование не только основного, но и побочных продуктов реакции.
Итак, вернемся к решению задачи. Из процесса получения серной кислоты, мы видим, что вся содержащаяся в пирите (FeS2) сера расходуется на образование серной кислоты (H2SO4). Из суммарного уравнения реакции следует, что из 1 моль пирита (FeS2) образуется 2 моль серной кислоты (H2SO4), что позволяет составить схему стехиометрического процесса:
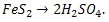

Рассчитаем молярные массы пирита (FeS2) и серной кислоты (H2SO4):
M (FeS2) = 56 + 2 ∙ 32 = 120 (г/моль).
M (H2SO4) = 2 + 32 +4 ∙ 16 = 98 (г/моль).
Учитывая, что молярные массы пирита (FeS2) и серной кислоты (H2SO4) соответственно равны 120 и 98 г/моль, воспользуемся стехиометрической схемой для проведения расчета:
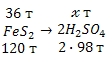
из 120 т FeS2 можно получить 196 т H2SO4
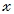
из 36 т FeS2 можно получить т H2SO4
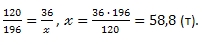
Ответ: 58,8 т серной кислоты.
Источник: himik.pro
Способ получения серы из пиритсодержащего материала

ОПИСАНИЕ ИЗОБРЕТЕНИЯ Союз Советскик Социалистических Республик(51) М., Кл. С 01 В 17/06 Государстаеиимй комитет СССР по делам изобретений и открнтий(72) Авторы изобретения Казахский политехнический институт ИМ.
В. И. Ленинаи Всесоюзный ордена Трудового Красного Знамени»научно-,исследовательский горнометаллургический институтцветных металлов(54) СПОСОБ ПОЛУЧЕНИЯ СЕРЫ ИЗ ПИРИТСОДЕРЖАЩ);ГО МАТЕРИАЛАИзобретение относится к технологииполучения элементарной серы из пиритсодержащего сырья и может быть использовано в цветной металлургии и хими 5ческой промышленности.Известен способ получения элементарной серы путем термической диссоциации пирита без доступа посторонни:.газов в зону реакции, при этом в газах содержится в основном элементарная сера и небольшое количество сернистого ангидрида, образовавшегося. за счет адсорбированного сырьем кислорода воздуха. Извлечение серы в газв этом способе достигает 50 1 1,Недостатком данного способа является необходимость тщательной герметизации оборудования,Наиболее близким к предлагаемомуявляется способ извлечения серы из пирита, согласно которому пирит нагревается в инертной атмосфере.
При этомчасть серы выделяется в газ в видеэлементарной. Твердый остаток обрабатывается кислотой с растворением железа и образованием сероводорода.
Врезультате термической диссоциациипирита в газ извлекается до 50 серыв виде элементарной и связанной в соединения.30 При кислотной обработке твердогопродукта термической диссоциации вгаз извлекается в виде сероводородадо 47-48 серы (от исходной) . Извлечение серы из газов термической диссоциации в элементарную не превышает80-85 при использовании громоздкойкаталитической технологии и конденсации, т. е, в товарный продукт извлекается до 42-43 серы от исходной.В процессе диссоциации совместно ссерой отгоняются летучие соединенияцветных металлов и механически увлеченные нелетучие компоненты, загрязняющие сконденсированную серу, вследствие чего она требует дополнительнойочистки,Извлечение серы из сероводородныхгазов кислотной обработки твердогопродукта термической диссоциации пирита осуществляется путем окислениясероводорода (метод Клауса), при.этом извлечение серы из сероводородадостигает 90-92, что составляет 4243 от исходного сырья. При этом сераполучается более высокого качества,чем полученная при термической диссоциации.
Суммарное извлечение серыв товарную из газов термической диссоциации и сероводородных газов кис859288 4 лотной обработкн может составить 84- 86 21Однако для укаэанного способа характерно недостаточно высокое извлечение серы в товарную элементарную серу. Кроме того, около половины извлекаемой серы получается в виде низкосортного продукта, загрязненного примесями.Цель изобретения — повышение степени извлечения и чистоты серы.Указанная цель достигается тем, что термическую диссоциацию пиритсодержащего материала проводят с подачей в газовую фазу кислородсодержащего газа при расходе кислорода 0 353У 0,42 нм на килограмм отгоняемой се ры, а газы после выделения элементарной серы конденсацией подвергают взаимодействию с сероводородом, полученным на стадии кислотной обработки твердого продукта термической диссо циации.За счет подачи в газовую фазу кислородсодержащего газа с указанным рас ходом достигается частичное окисление элементарной серы до получения в га зах термической диссоциации отношения количества элементарной серы к сернистому ангидриду, близкого 1:2.
После конденсации элементарной серы газ, содержащий сернистый ангидрид, подвер-З 0 гают взаимодействию с сероводородом, полученным на стадии кислотной обработки. При этом соотношение количества сероводорода к сернистому ангидриду удовлетворяет стехиометрии реакции получения элементарной серы Показатели 1 2 Извлечение серы вгаз при диссоциации,50,0 50,0 12,5 21,0 12,5 24,0 Подано воздуха наокисление, г/л 0,40 0,35 Сконденсировано серыпосле окисления, г 5,60 6,55 Содержание серы всконденсированной,95,6 95,5 Извлечение серы всконденсированную,21,4 25,0 Извлечение серы вгаз при кислотнойобработке,48,0 48,0 16,5 Содержанке серы вней,99,5 99,5 66,0 66,0 Извлечение серы,87,4 91,0 В сопоставимых убповиях по известному способу в серу, сконденсированную иэ газов диссоциации, извлекается 42,5, в серу, полученную из сероводорода — 43,2, всего 85,7.
2 Н 5 + 502 — ф 2 Н 0 + 35 (1).Основная масса примесейперешедшихв газ при диссоциации, концентриуется 40,в сере, полученной при конденсации(выход 25), за счет чего остальные .75 извлеченной серы получаются более высокого качества. Так как после конденсации элементарной серы газы термической диссоциации перерабатываются совместно с сероводородними газами кислотной обработки, то повышается степень утилизации, эа счет чего повышается общее извлечение серы в эле ментарную.
Кроме того, осуществление термической диссоциации с частичным окислением элементарной серы в газах позволяет снизить требования к герметизации реактора термической диссоциации и газоходной системы и необходимо лишь для того, чтобы за счет подсосов и подачи кислородсодержащего газа в систему быпо подано не более 0 42 нмкислорода на килограмм отогнаиной при диссоциации серы. 40П р и м е р. Навеску пиритного концентрата (50 г), содержащего 43,7 железа и 50,0 серы, в течение 30 мин подвергают термической диссоциации при 1250 в токе аргона 6(20 л/опыт), служащего для создания неокисляющей среды и транспортировки паров серы из зоны реакции.На выходе из реакционной эоны сера в газах частично окисляется за счет подачи воздуха, Путем охлаждения из газов кондеисируют элементарную серу, после чего гаэ пропускают через сосуд с водным раствором для поглощения сернистого ангидрида.
Продукт диссоциации обрабатывают раствором соляной кислоты концентрацией 180 г/л в течение 2 ч при отношении Ж:Т = 5:1 и температуре 80 фС. Полученные при этом сероводородные газы пропускают через сосуд с раствором от предыдущей операции, в результате чего иэ раствора выделяется элементарная сера.В таблице приведены результаты проведенных испытаний.
Расход кислорода на1 кг отогнанной серы,им Получено серы привзаимодействии сероводорода с сернистымгазом, г 16,5 Общее извлечение серы.в элементарную,859288 формула изобрете ния Составитель В. Шабалин Редактор М. Митровка Техред А; Ач Корректор А. ГриценкоТираж 505 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж, Раушская наб., д. 4/5Заказ 7452/35 филиал ППП фПатентф, г. ужгород, ул. Проектная, 4 Таким образом, предлагаемый способ, по сравнению с известным дает увеличение суммарного извлечения серы на 1,7-5,3, Кроме того, Доля высококачественной серы в общем выпуске увеличивается с 50 до 72-75.
Способ получения серы из пиритсодержащего материала, включающий термическую диссоциацию после)знего, выделение элементарной серы конденсацией из газообразных продуктов, обработку твердого продукта термической диссоциации кислотой с получением се-роводорода, о т л и ч а ю щ и й с ягем, что, с целью повышения степениизвлечения и чистоты серы, термическую диссоциацию ведут с подачей в газовую Фазу кислородсодержащего газапри расходе кислорода 0,35-0,42 нмна 1 кг отгоняемой серы, а газы после выделения элементарной серы подвергают взаимодействию с сероводородом, полученным на стадии кислотнойобработки.Источники информации,принятые во внимание при экспертизе1. Авторское свидетельство СССРВ 325801, кл. С 01 В 17/06 1969,2. Патент Великобритании 9 1128686,кл. С (1 ) А, С 01 В 17/06, 1968.
Заявка
КАЗАХСКИЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ ИМ. В. И. ЛЕНИНА, ВСЕСОЮЗНЫЙ ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ НАУЧНО ИССЛЕДОВАТЕЛЬСКИЙ ГОРНОМЕТАЛЛУРГИЧЕСКИЙ ИНСТИТУТ ЦВЕТНЫХ МЕТАЛЛОВ
ЛУГАНОВ ВЛАДИМИР АЛЕКСЕЕВИЧ, ШАБАЛИН ВЛАДИМИР ИВАНОВИЧ, ФЕЛЬДМАН ВЛАДИМИР ГРИГОРЬЕВИЧ, ВИХАРЕВ ИВАН ГРИГОРЬЕВИЧ, КУУР ВЯЧЕСЛАВ ПЕТРОВИЧ, ДОКУЧАЕВ ПАВЕЛ НИКИТОВИЧ, НЕВОЛИН АНАТОЛИЙ АЛЕКСАНДРОВИЧ
Источник: patents.su
Что такое пирит? Свойства, добыча, применение и цена пирита
Золото дураков . Так в народе именуют пирит. Ищут его не в сказочной стране Дураков из повести Алексея Толстого о Буратино, а в реальной жизни.
Хотя, россыпи кристаллов можно назвать полями чудес. Глядя на них, неопытные старатели приходили в восторг, думая, что нашли золото .

Однако скупщики металла лишь посмеивались над горемыками и обзывали дураками. К золоту пирит не имеет отношения. Тогда к чему же имеет?
Что такое пирит?
Металл в составе пирита есть, однако, это не золото , а железо . Отсюда еще одно название камня – железный колчедан. Металл в нем соединен с серой.
Соответственно, с формулой FeS2 камень является сульфидом, точнее, дисульфидом, ведь атома серы два. На железо приходятся 46,6% состава.
Сере достаются 53,4%. Однако, это в идеале. В чистом виде формула пирита встречается лишь в книгах . В природе к ней примешиваются медь , кобальт , никель , селен .
Золото , кстати, тоже примешивается к руде. Однако, количество аурума столь малы, что их извлечение из камня не целесообразно.
Сие равнозначно добыче металла из человеческого организма. В нем содержатся около 10-ти миллиграммов золота .
Внешне пирит – камень, образующий кубические кристаллы . Для золота они не типичны, хоть и встречаются. Встречаются, так же, октаэдры.

Это объемные ромбы о 8-ми гранях. Однако, в 85% случаев золото предстает в виде мельчайших песчинок, которых в породе даже не видно невооруженным глазом .
К тому же, у золота желтая черта, то есть, порошок, оставляемый при трении о керамическую табличку. У пирита же черта свинцово — серая .
С точки зрения геологов пирит – минерал, то есть, твердое, однородное, кристаллическое тело. Камень самодостаточен, но может присоединяться к горным породам, в основном, магматическим.
Свойства пирита
На фото пирит имеет выраженный металлический блеск . Однако, видеть его на снимках, или в реальной обстановке, не означает видеть героя статьи .
На воздухе происходит окисление пирита. Он реагирует с кислородом, преобразуясь в гетит или лимонит . Первый – минерал, второй – порода, содержащая гетит и еще ряд гидроксидов железа.
Масса пирита меняется, так же, при контакте с подземными водами. Итог тот же – гетит и лимонит. В них переходит не весь железный колчедан, а лишь его поверхностная часть.
Золотисто- желтый цвет сменяется коричневым . Окислая пленка лимонита отличается побежалостью. Она выражается в радужных переливах на поверхности, словно в лужах с бензином .
Есть, так же, несколько минералов похожих на героя статьи, но не связанных с ним. Так у халькопирита в формулу вклинивается медь . Твердость камня снижается до 4-ех баллов против 6-6,5 у обычного пирита. Цвет становится более желтым.

С твердостью в 6,5 баллов пирит становится единственным сульфидом, способным поцарапать минеральное стекло . Самоцветы группы от природы мягки.
В стекле же значительна примесь кварца с твердостью в 7 баллов. Будучи разбавленным прочими компонентами, кремнезем немного теряет «силу». В итоге, твердость стекла по шкале Мооса составляет около 6-ти баллов.
Похож на пирит и кобальтин. В нем железа нет вовсе. Сера сочетается с кобальтом и мышьяком . Последний элемент в качестве примеси бывает и в герое статьи. Твердость кобальтина не превышает 4-ех баллов по шкале Мооса.
Желтый цвет не выражен. Менее насыщен он и у пирротина. Это простой сульфид железа с твердостью в 4,5 единицы и более темным, чем у пирита, цветом .
Отличает пирит и плотность. Она выше среднего, достигает 5,10 грамма на кубический сантиметр руды. Соответственно, герой статьи увесист.
Однако, до тяжести золота камню далеко. Плотность самородного аурума составляет 19 граммов на каждый сантиметр в кубе.
Пирит свойство имеет замещать полости в породах и даже органике. Герой статьи признан самым распространенным сульфидом. Будучи повсюду, минерал проникает даже в раковины моллюсков и стволы отмерших деревьев .
В итоге, в горных, равнинных выработках находят древние аммониты и сосны, до «краев» заполненные пиритом. Железо, выглядящее как золото , к тому же, с историей в миллионы лет, — заманчивое предложение. Дабы представить красоту камня в «раме» живого организма, раковины и стволы распиливают.
У пирита нет плоскостей спайности. Соответственно камень не склонен раскалываться в определенных направлениях, прочен.
Однако, химическая неустойчивость минерала делает его опасным, особенно, вблизи с углем . Почему? Об этом поговорим в следующей главе.
Добыча и месторождения пирита
Будучи самым распространенным сульфидом на земле, пирит встречается и в магматических, и в метаморфических, и в осадочных слоях. В первых руда становится эпигенетическим элементом.
Он стоит над изначальной «генетикой» камня. Проще говоря, сначала образовались магматические породы, а потом поры в них заполнил пирит. Серы и железа пласты «хлебнули» из гидротермальных вод, сочащихся из-под земли.
Получается, герой статьи рождается в процессе контактного метаморфизма – преобразования пород на контакте друг с другом по средствам горячих, напитанных минералами вод, или давления.
Чаще всего, пирит встречается на границе магматических и осадочных пород. К последним относится и каменный уголь. Это полезное ископаемое и железная руда представляет практический интерес.

Однако, добывать уголь и пирит вместе чревато пожарами. Рядом с топливом, получая через выработки доступ к кислороду, герой статьи самовоспламеняется.
Обжиг пирита приводит к выбросу в атмосферу вредных примесей, содержащихся в колчедане, к примеру, мышьяка. Рабочие травятся.
Поэтому в шахтах с колчеданом распыляют известковый порошок. Он тормозит окисление пирита, а следовательно и воспламенение.
Кстати, имя руды переводится с греческого как « огонь ». Искрится минерал не только при контакте с кислородом, но и при ударах о сталь .
Свойство проводника в названии героя статьи не отражено. Между тем, в минерале есть запас свободно перемещающихся частиц.
Они несут не только заряд, но и передают по цепи ток. Хотя, знатоки фэн шуй утверждают, что железный колчедан проводит, так же, богатство и благополучие.
О магических свойствах пирита, его применении в эзотерике и за ее пределами поговорим в следующей главе.
Применение пирита
Набивая карманы пиритом, золотоискатели прошлого проходили вблизи удачи . Железный колчедан является спутником солнечного металла и по совместительству его антиподом.
Золото податливо, а пирит сложно обрабатывается. Драгоценный металл химически инертен, не склонен вступать в реакции с прочими элементами и веществами, а колчедан «тянет» на взаимодействия.

На фото бусы из пирита
Как и в человеческом обществе, противоположности притягиваются. Там, где есть пирит, часто находят и золото . Вопрос лишь в количестве драгоценных запасов и форме их проявления.
Кроме маяка в поиске золота , пирит служит источником нескольких веществ. Логично получение из минерала железа. Его пускают, в основном, на производство чугуна .
Второй компонент руды тоже не остается без внимания. Правда, последние годы серу чаще получают при переработке природного газа и нефти .
На производство побочного биопродукта тратится в разы меньше, чем на извлечение элемента из пирита. Чаще, из него извлекается серная кислота. Из пирита ее получают реакцией с кислородом.
В ее ходе получаются оксиды серы и железа. Союз серы с кислородом донасыщают газом, а после совмещают с водой. Вот и серная кислота .
Оправдано и извлечение из колчедана редких примесей. Это талий, селен, в общем, редкоземельные, но нужные промышленности металлы . Даже небольшая их доля в руде – «лакомый кусочек».
В прошлые века кристаллы железного колчедана измельчали и в паре со сталью закладывали в кремниевые ружья. Трение компонентов давало искры, необходимые для выстрелов.
Необходимостью пирит был и в быту. В эпоху без зеркал камень отражал, давая возможность прихорошиться. Первыми смотреться в пирит стали инки. Ровные грани кристаллов не искажали изображение, в отличие, к примеру, от выпуклого перламутра .
В 21-ом веке купить пирит для кремниевых ружий желают только киношники, восстанавливающие реалии исторических событий.
Вне съемочных площадок кремниевых стволов уже не существует. А вот ювелирные украшения – явление постоянное. Меняются лишь камни-фавориты.
На пирит первыми взглянули мастера Древней Греции. Они оценили красоту камня и его магические свойства. Кубические, блестящие, словно отполированные, кристаллы минерала можно не обрабатывать.

На фото кольцо с пиритом
При этом, украшения будут эффектнее многих. Изделия отбрасывают блики, способные ослепить. Поэтому, древние греки брали кристаллы пирита на поля брани. Считалось, так же, что талисманы из железного колчедана восполняют потерю крови .
Исчезла Греция, утихла и слава пирита. Вне контекста золотой лихорадки и запалов кремниевых ружий на него взглянули лишь в 20-ом веке.
Из пирита делают серьги , статуэтки , шкатулки , бусы , браслеты , перстни. Особая категория – фигурки денежных лягушек и прочих символом богатства.
Энергетика пирита притягивает финансы, усиливая влияние статуэток на жизнь их владельцев. Правда, бесплатно денежный талисман не достается. Поговорим о расценках.
Цена пирита
39-сантиметровая нить пиритовых бусин для рукоделия из них стоит около 900-от рублей. Это при условии, что диаметр бусин составляет 5-7 миллиметров.
Если брать необработанные кристаллы, за куб 2 на 2 сантиметра отдашь примерно 1 000 рублей . Вариант для минералогической коллекции.
Для коллекции фэн шуй присмотрим Будду из пирита. Статуэтка высотой 15 и шириной 8 сантиметров оценивается в 13 000-15 000 рублей. Получение пирита за такие деньги понятно не всем.
Но, китайцы уверены, что игра стоит свеч. Именно в Поднебесной железный колчедан провозгласили символом богатства и за несколько веков не разочаровались в своих убеждениях.
Источник: tvoi-uvelirr.ru